В таблице Менделеева группа металлов или группа 3-12 представляет собой ряд элементов, расположенных от титана (Ti) до меди (Cu). Эти металлы характеризуются уникальными химическими свойствами и множеством особенностей, которые делают их неотъемлемой частью современного мира.
Одной из отличительных особенностей группы металлов является их способность образовывать катионы с различными зарядами. Это связано с наличием внутренних энергетических уровней, которые позволяют металлам изменять свою степень окисления в химических реакциях. Так, например, марганец (Mn) может образовывать катионы Mn2+ и Mn4+, в то время как железо (Fe) может образовывать Fe2+ и Fe3+. Эта особенность делает группу металлов важной для множества процессов, включая электрохимические реакции и катализаторы.
Еще одной особенностью группы металлов является их высокая проводимость электричества и тепла. Это связано с наличием свободных электронов в их электронных оболочках, которые могут свободно перемещаться и создавать электрический ток. Благодаря этим свойствам металлы широко применяются в электротехнике, производстве металлоконструкций и других областях промышленности. Кроме того, они обладают высокой теплоемкостью и способностью сохранять тепло, что делает их важными материалами для строительных конструкций и отопительных систем.
В группе металлов также можно найти элементы со специфическими свойствами. Например, цирконий (Zr) обладает высокой коррозионной стойкостью и используется в производстве ядерных реакторов и химической промышленности. Иногда редкие металлы, такие как иттрий (Y) и лантан (La), также относят к группе металлов, хотя они имеют свои особенности и широко применяются в других отраслях науки и промышленности.
Свойства металлов в таблице Менделеева
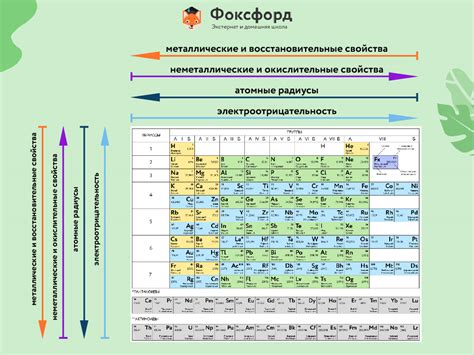
Металлы – это группа элементов в таблице Менделеева, которые обладают определенными химическими свойствами и особенностями. Они обычно обладают блестящей поверхностью, хорошей тепло- и электропроводностью, высокой пластичностью и прочностью. Металлы также обладают способностью образовывать ионные соединения и амфотерные химические реакции.
Одной из особенностей металлов является их способность образовывать катионы, положительно заряженные ионы. Это связано с их низкой электроотрицательностью, которая позволяет им отдавать электроны другим элементам при химических реакциях. Более того, металлы имеют обыкновение образовывать ионные кристаллы, состоящие из положительно заряженных ионов и отрицательно заряженных анионов.
Металлы имеют высокую тепло- и электропроводность из-за свободного движения электронов в их структуре. Внутренние электроны металлов образуют электронное облако, которое может двигаться по всей структуре металла и передавать электрический ток от одного места к другому. Это объясняет, почему металлы являются хорошими проводниками электричества и тепла.
Металлы также обладают высокой пластичностью и прочностью, что делает их полезными для производства различных изделий и конструкций. Благодаря своей способности подвергаться деформации без разрушения, металлы могут быть легко прокатаны, вытянуты и отлиты в различные формы и размеры.
Одной из важных характеристик металлов является их способность образовывать амфотерные химические реакции, то есть реагировать как с кислотами, так и с основаниями. Благодаря этому свойству металлы могут образовывать различные соли, которые широко используются в химической промышленности и других отраслях.
Группа "Щелочные металлы": реакционная способность и свойства
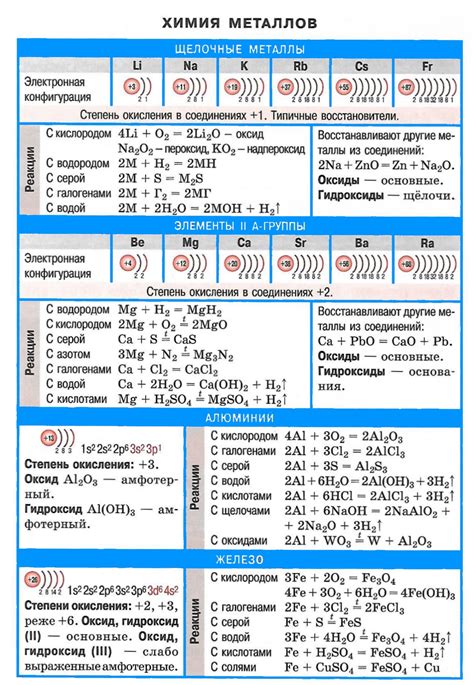
Щелочные металлы - это элементы первой группы таблицы Менделеева, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают высокой реакционной способностью и активностью, что делает их одними из самых химически активных элементов.
Одной из основных характеристик щелочных металлов является их способность образовывать ионы с положительным зарядом. Наиболее характерным и стабильным состоянием ионов щелочных металлов является +1 заряд. Это связано с тем, что первая энергия ионизации этих элементов очень низкая, что позволяет им легко отдавать один электрон и образовывать ионы.
Самой яркой и характерной реакцией щелочных металлов является их реакция с водой. При этой реакции возникает образование газа водорода и образование щелочных гидроксидов. Например, калий вступает в бурную реакцию с водой, при которой образуется гидроксид калия и выделяется водород.
Еще одним важным свойством щелочных металлов является их способность образовывать соединения с кислородом, называемые оксидами. Щелочные металлы образуют оксиды с формулой MO, где M представляет собой металл. Например, литий образует оксид Li2O, а натрий образует оксид Na2O. Эти оксиды являются сильными основаниями, способными реагировать с кислородом и образовывать гидроксиды.
Металлы группы "Щелочноземельные металлы": мягкость и восстановительные свойства
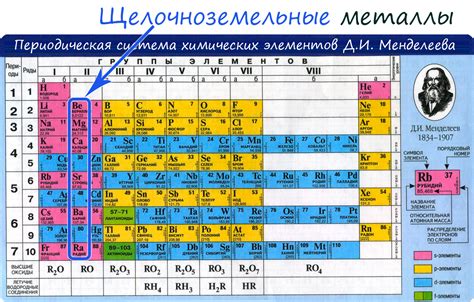
Щелочноземельные металлы представляют собой важную группу металлов в таблице Менделеева. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Одной из особенностей этих металлов является их мягкость, которая увеличивается по мере увеличения атомного номера.
Щелочноземельные металлы хорошо известны своими восстановительными свойствами. Они способны образовывать ионы с положительной валентностью, что делает их отличными восстановителями. Эти металлы активно реагируют с кислородом, формируя оксиды, с халогенами, образуя соли, а также проявляют реакцию с некоторыми неметаллами, например, сероводородом. Большинство щелочноземельных металлов также реагируют с водой, образуя гидроксиды и высвобождающийся водород.
Щелочноземельные металлы активно применяются в различных сферах науки и техники. Бериллий широко используется в производстве сплавов с другими металлами, таких как алюминий, никель и медь, благодаря его легкому весу, высокой теплопроводности и прочности. Магний является важным компонентом легких сплавов, используемых в авиационной и автомобильной индустрии. Кальций и барий применяются в различных процессах, связанных с получением стали и чистыми химическими веществами.
Таким образом, щелочноземельные металлы обладают мягкостью и восстановительными свойствами, которые делают их важными и полезными в различных областях науки и промышленности.
Группа "Полуметаллы": уникальная комбинация металлических и неметаллических свойств
Группа полуметаллов в таблице Менделеева представляет собой особую категорию элементов, которые обладают уникальной комбинацией металлических и неметаллических свойств. Эти элементы находятся на стыке двух миров, и их химические свойства отличаются от других групп.
Основными представителями группы полуметаллов являются элементы бор (B), кремний (Si), германий (Ge), арсений (As), селен (Se), теллур (Te) и полоний (Po). Они обладают как металлическими, так и неметаллическими свойствами, что делает их особым и интересным объектом изучения.
Металлические свойства полуметаллов проявляются в их физических характеристиках, таких как электропроводность и теплопроводность. Но их металлические свойства ограничены, и они обладают более слабой электропроводностью и теплопроводностью по сравнению с обычными металлами.
Неметаллические свойства полуметаллов проявляются в их способности образовывать ковалентные связи и образовывать два типа ионов с разными зарядами. Это позволяет полуметаллам образовывать разнообразные химические соединения с другими элементами и проявлять как неметаллические, так и металлические свойства в этих соединениях.
Группа полуметаллов представляет большой интерес для научных исследований и применений в различных областях, включая электронику, солнечные батареи, полупроводники и другие технологические процессы. Изучение химических свойств и особенностей полуметаллов позволяет расширить наши знания о мири элементов и применить их в новых областях науки и техники.
Металлы группы "Постпереходные металлы": тугоплавкость и высокая плотность

Постпереходные металлы – это группа химических элементов, которая расположена между переходными металлами и металлоидами в таблице Менделеева. Эти металлы обладают рядом уникальных химических свойств и особенностей.
Одной из особенностей постпереходных металлов является их тугоплавкость. Большинство элементов этой группы обладают очень высокой температурой плавления, что делает их сложными для обработки и использования в промышленности. Например, такие металлы как вольфрам, молибден и рений имеют очень высокую температуру плавления, что позволяет им использоваться в производстве специальных аппаратов и инструментов, которые выдерживают высокие температуры.
Другой характеристикой постпереходных металлов является их высокая плотность. В связи с этим, многие из этих металлов применяются в различных отраслях промышленности. Например, олово, что относится к группе постпереходных металлов, имеет достаточно высокую плотность, что позволяет использовать его в производстве различных приборов и устройств, где требуется прочный и плотный материал.
Таким образом, постпереходные металлы отличаются тугоплавкостью и высокой плотностью, что делает их ценными и востребованными в различных отраслях промышленности и научных исследованиях. Их уникальные химические свойства и особенности позволяют эффективно использовать их для создания новых материалов и технологий.
Группа "Переходные металлы": цветность, магнитные свойства и каталистическая активность
Переходные металлы представляют собой группу элементов в таблице Менделеева, обладающих рядом уникальных химических свойств и особенностей. Одной из самых заметных характеристик переходных металлов является их цветность. Многие из них обладают яркими окрасками и могут быть использованы в производстве красителей и пигментов. Например, медь имеет красно-оранжевый цвет, а никель - серебристо-белый.
Еще одним выдающимся свойством переходных металлов является их магнитная активность. Некоторые из них обладают способностью притягивать металлические предметы или образовывать магнитные материалы. Это явление основано на спиновом магнетизме атомов переходных металлов и создает широкий спектр применений, включая производство постоянных магнитов и магнитных сплавов.
Каталистическая активность также является важным свойством переходных металлов. Многие из них обладают способностью ускорять химические реакции, не изменяя при этом своей структуры и формы. Это делает их незаменимыми компонентами в процессах катализа, применяемых в промышленности, включая производство пластиков и удобрений.
В целом, переходные металлы отличаются от других групп элементов своими уникальными химическими свойствами и способностями. Их цветность, магнитные свойства и каталистическая активность играют важную роль в различных областях науки и промышленности, делая их неотъемлемой частью современного мира.
Металлы группы "Лантаноиды": сходство свойств и применение в высокотехнологичных отраслях
Металлы группы "Лантаноиды", также известные как лантаноиды или редкоземельные элементы, представлены в таблице Менделеева достаточно узкой группой из 15 элементов. Данные металлы обладают рядом характерных свойств, которые делают их полезными во многих высокотехнологичных отраслях.
Одна из важных характеристик лантаноидов - их высокая атомная ионизационная энергия, что делает их хорошими проводниками электроизоляции и надежно удерживающими электроны. Лантаноиды также отличаются высоким показателем парамагнетизма и способностью к образованию соединений с различными элементами, что расширяет их применение в различных химических процессах.
Применение лантаноидов в высокотехнологичных отраслях весьма обширно. Например, они находят применение в производстве катодов для источников света, включая лампы накаливания и компактные люминесцентные лампы. Благодаря своей фотолюминесцентной способности, лантаноиды применяются в производстве красок, которые обладают большой яркостью и долговечностью. Они также используются в качестве катализаторов в фармацевтической промышленности и нефтепереработке, а также в технологии производства оптических стекол и волокон.
- Сходство свойств лантаноидов:
- Высокая атомная ионизационная энергия.
- Парамагнетизм.
- Образование соединений с другими элементами.
Благодаря своим уникальным химическим свойствам, металлы группы "Лантаноиды" широко используются в современных высокотехнологичных отраслях и играют важную роль в развитии современной науки и технологии.
Группа "Актиноиды": радиоактивность и использование в ядерной энергетике
Актиноиды - это серия химических элементов, расположенных в "ф-блоке" таблицы Менделеева. Эти элементы характеризуются высокой степенью радиоактивности, которая связана с их нестабильной структурой ядра.
Основным приложением актиноидов является их использование в ядерной энергетике. Некоторые актиноиды, такие как уран, плутоний и торий, являются ключевыми компонентами ядерных реакторов и ядерных бомб.
Уран, самый известный актиноид, используется в ядерных реакторах для производства электричества. Уран-235 является основным изотопом, используемым в этой отрасли. Другие актиноиды, такие как плутоний, также используются для производства электричества в ядерных реакторах.
Кроме того, актиноиды используются в процессе облучения для получения различных радиоактивных изотопов, которые находят применение в медицине, научных исследованиях и других областях. Например, актиноиды могут быть использованы для производства радиофармакологических препаратов, которые используются в онкологии для лечения рака.
Постпереходные металлы: мягкость, низкая плотность и широкое применение

Постпереходные металлы – это группа элементов в таблице Менделеева, расположенная между основными и полупроводниковыми элементами. Они обладают рядом характерных свойств, которые делают их уникальными.
Во-первых, постпереходные металлы отличаются низкой плотностью. Это связано с их атомной структурой, в которой атомы металла расположены в пространстве с большими межатомными расстояниями. Из-за этого эти металлы обладают высокой прочностью и пластичностью, что делает их легкими в обработке и формовке.
Во-вторых, постпереходные металлы обладают мягкостью, то есть они имеют низкую твердость. Это связано с их электронной структурой, в которой электроны находятся на разных энергетических уровнях и образуют слабые связи. Из-за этого постпереходные металлы могут быть легко обработаны резанием, изготовлением крупногабаритных изделий и формовкой.
В-третьих, постпереходные металлы имеют широкое применение в различных отраслях промышленности. Из-за своей мягкости и низкой плотности они идеально подходят для изготовления легких и прочных конструкций, например, в авиационной и автомобильной промышленности. Они также используются в производстве металлических сплавов, которые имеют широкое применение в машиностроении и электротехнике. Благодаря своим уникальным свойствам, постпереходные металлы востребованы и находят применение в различных сферах деятельности человека.
Вопрос-ответ

Какие металлы входят в группу металлов в таблице Менделеева?
В группу металлов в таблице Менделеева входят основные металлы, такие как железо, медь, алюминий, цинк, никель, свинец, магний и т. д. Это металлы с положительными значениями температуры плавления и плотности, хорошей проводимостью тепла и электричества.
Что такое химические свойства металлов?
Химические свойства металлов - это их способность образовывать ионы положительного заряда и вступать в химические реакции с другими веществами. Металлы обычно обладают высокой активностью, легко окисляются и действуют как восстановители в реакциях.
Какие особенности металлов выделяют их среди других элементов?
Металлы обладают рядом особенностей, которые выделяют их среди других элементов в таблице Менделеева. Некоторые из этих особенностей включают высокую теплопроводность, электропроводность, гибкость, блеск и проводимость. Кроме того, они обычно имеют высокую плотность, твердость и точки плавления.
Как металлы влияют на нашу жизнь и промышленность?
Металлы играют важную роль в нашей жизни и промышленности. Они используются для производства различных материалов и изделий, таких как машины, здания, электроника, транспортные средства и многое другое. Некоторые металлы также применяются в лекарственных препаратах и в процессе получения энергии.
Какие металлы являются самыми распространенными и важными?
Самыми распространенными и важными металлами являются железо, алюминий, медь, свинец и цинк. Железо, например, используется в производстве стали, алюминий - в авиационной и автомобильной отраслях, медь - в электротехнике, свинец - в аккумуляторах, а цинк - в гальванической промышленности.
