Щелочноземельные металлы – это элементы, которые находятся во 2-й группе периодической таблицы. Главная подгруппа щелочноземельных металлов состоит из четырех элементов: бериллия (Be), магния (Mg), кальция (Ca) и стронция (Sr).
Каждый из щелочноземельных металлов обладает определенными свойствами, которые делают их ценными и широко используемыми в различных сферах науки и промышленности. Например, бериллий является легким и прочным металлом с высокой теплопроводностью. Магний обладает низкой плотностью и высокой прочностью, а также является хорошим проводником электричества. Кальций и стронций широко используются в производстве различных материалов и соединений, включая цемент, стекло и красители.
Щелочноземельные металлы имеют свойства, характерные для металлов: они хорошие проводники тепла и электричества, имеют металлический блеск, обладают высокой пластичностью и деформируются пластически без разрушения. Однако они имеют низкую плотность и обладают некоторой прочностью и жесткостью.
В целом, главная подгруппа щелочноземельных металлов представляет собой важную группу элементов с уникальными свойствами и широким спектром применения. Изучение их химических и физических свойств имеет большое значение для различных областей науки и технологии.
Свойства и особенности щелочноземельных металлов
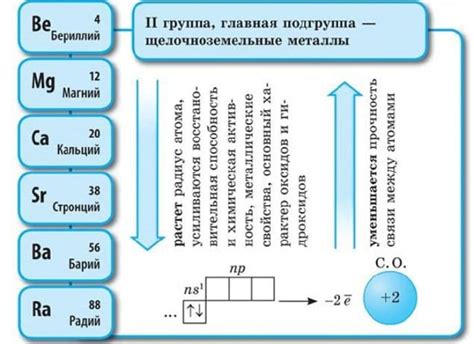
Щелочноземельные металлы - это группа химических элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Они располагаются во 2-й группе периодической таблицы Менделеева и обладают множеством уникальных свойств и особенностей.
Первое заметное свойство щелочноземельных металлов - их металлический блеск и серебристо-белый цвет. Они обладают высокой температурой плавления и кипения, а также отличной электропроводностью, что делает их ценными материалами для различных технических применений.
Одной из основных характеристик щелочноземельных металлов является их высокая реакционность с водой и кислородом. Они реагируют с водой, образуя щелочные растворы и выделяя водород. Кроме того, они активно соединяются с кислородом, образуя оксиды. Эти реакции являются хорошими примерами их сильной химической активности.
- Каждый щелочноземельный металл обладает своими уникальными физическими и химическими свойствами:
- Бериллий - легкий, прочный и хорошо проводит тепло.
- Магний - легче всех металлов, хорошо сгорает на воздухе.
- Кальций - важный элемент для живых организмов, участвует в костнообразовании.
- Стронций - используется в производстве пиротехнических смесей.
- Барий - применяется в медицине для рентгенологического исследования.
В целом, щелочноземельные металлы имеют широкий спектр применений в различных отраслях промышленности и научных исследованиях. Их свойства и особенности делают их неотъемлемой частью нашей жизни.
Химическая активность щелочноземельных металлов

Щелочноземельные металлы, входящие в главную подгруппу второй группы периодической системы элементов, проявляют высокую химическую активность. Это связано с их электронной конфигурацией, которая состоит из двух электронов на внешнем энергетическом уровне.
Химическая активность щелочноземельных металлов проявляется в их способности образовывать ионы с положительным зарядом, претерпевая окисление и потерю электронов при реакции с другими веществами. Эти металлы обладают способностью активно взаимодействовать с кислотами, образуя соли и выделяя при этом водород.
Основной химической реакцией щелочноземельных металлов является реакция с водой, в результате которой образуется щелочные растворы и выделяется водород. Эта реакция энергичная и сопровождается появлением пламени. Кроме того, щелочноземельные металлы обладают способностью образовывать двухатомные диоксиды (ХО2), которые взаимодействуют с водой, образуя щелочные растворы и водород.
Щелочноземельные металлы также могут реагировать с кислотами, образуя соли. В этом процессе ионы металлов замещают водородные ионы солей. Реакция металлов с кислотами протекает достаточно быстро и сопровождается выделением тепла.
Химическая активность щелочноземельных металлов также проявляется в их способности образовывать соединения с другими элементами, такими как кислород, сера, фосфор и другие. Это приводит к образованию различных оксидов, сульфидов, фосфидов и других соединений, которые имеют разнообразные свойства и применения.
Применение щелочноземельных металлов в технологии
Кальций, один из щелочноземельных металлов, является одним из наиболее распространенных элементов в природе. Он широко используется в различных отраслях технологии. В металлургии кальций применяется для дезоксидации стали и алюминия. Он также используется в производстве сплавов, керамики и стекла. Благодаря своей химической активности, кальций широко применяется в процессе очистки воды и сточных вод.
Стронций используется в производстве огнетушителей и пиротехнических изделий благодаря своей светящейся способности. Этот металл также добавляют в стекло и керамику для придания им специальных свойств. Стронций играет важную роль в ядерной энергетике, где он используется в радиационных источниках, а также в исследованиях магнитных полей.
Барий находит широкое применение в медицине, где он используется для рентгеновского исследования органов и тканей, а также для улучшения качества рентгеновских снимков. Благодаря своей плотности, барий также используется в производстве суррогатов металлического шарика в ружейных и пушечных патронах. Кроме того, барий применяется в производстве электронных ламп, красок и катализаторов.
Радий, имеющий очень высокую радиоактивность, используется в радиотерапии для лечения рака. Он также используется в радиологии, анализе материалов и науке о материалах. В прошлом, радий использовался в свечах, покрышикх для часов и других светопроницаемых материалах, но из-за его радиоактивности, его применение сейчас ограничено.
Роль щелочноземельных металлов в организме человека

Щелочноземельные металлы играют важную роль в организме человека, поскольку они участвуют во множестве биологических процессов.
Кальций является одним из основных щелочноземельных металлов, которые необходимы для строения и поддержания здоровья костей и зубов. Он также играет важную роль в сокращении мышц, передаче нервных импульсов и секреции гормонов. Дефицит кальция может привести к остеопорозу и другим проблемам со здоровьем.
Магний также необходим для здоровья костей, так как он участвует в образовании костной ткани. Он также помогает восстановить мышцы после физической нагрузки и участвует в регуляции сердечного ритма. Магний также способствует улучшению усвоения кальция в организме.
Стронций играет важную роль в формировании костей и зубов, так как он замещает кальций в костной ткани. Его применяют также в медицинской диагностике, где он используется в виде радиоактивного изотопа для обследования костной системы.
Барий также является одним из щелочноземельных металлов, присутствующих в организме человека. Он увеличивает плотность костной ткани и может применяться в лечении некоторых форм рака.
В заключение, щелочноземельные металлы играют важную роль в организме человека в поддержании здоровья костей, нервной системы и мышц. Они также участвуют во множестве других биологических процессов и могут применяться в медицинской практике для диагностики и лечения различных заболеваний.
Взаимодействие щелочноземельных металлов с другими элементами
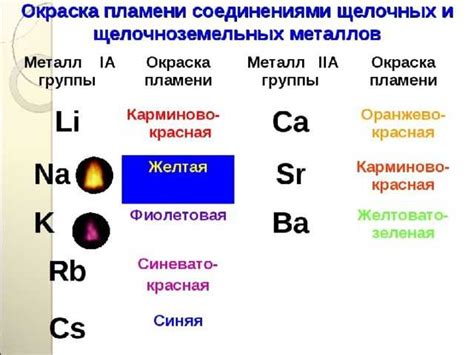
Щелочноземельные металлы из главной подгруппы второй группы периодической таблицы химических элементов обладают высокой активностью, что предопределяет их характерные свойства при взаимодействии с другими элементами.
Вода, кислород и хлор являются примерами реактивных веществ, с которыми щелочноземельные металлы вступают в реакцию. При контакте с водой они образуют гидроксиды и высвобождаются водород. Реакция щелочноземельных металлов с кислородом приводит к образованию аридных оксидов, в то время как соединения с хлором дают хлориды металлов.
Взаимодействие щелочноземельных металлов с кислородом, водой и хлором является эндотермическим процессом, что означает, что необходимо затратить энергию для проведения реакции. Данное свойство обуславливает их большую химическую активность и способность вступать во взаимодействие с различными веществами.
Соединения щелочноземельных металлов нашли применение в различных областях науки и промышленности. Например, гидроксиды щелочноземельных металлов широко используются в процессе нейтрализации кислых растворов, а оксиды – в производстве строительных материалов и пигментов.
Влияние щелочноземельных металлов на окружающую среду

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, оказывают значительное влияние на окружающую среду. Они присутствуют в природных и промышленных источниках и могут быть выпущены в атмосферу, почву и воду в результате деятельности человека.
Одним из основных источников выделения щелочноземельных металлов является промышленность. Например, при сжигании угля, содержащего высокие концентрации этих металлов, в атмосферу попадают оксиды магния, кальция, стронция и бария. Эти оксиды могут участвовать в химических реакциях, приводящих к образованию кислотных дождей, что негативно влияет на растительный и животный мир.
Щелочноземельные металлы также могут попадать в водные ресурсы. Например, испарения от промышленных химических процессов или сбросы сточных вод содержат высокие концентрации этих металлов. Увеличение содержания магния, кальция, стронция и бария в воде может привести к изменению ее химического состава и ухудшению качества питьевой воды.
Кроме того, щелочноземельные металлы оказывают влияние на почвенную среду. Они могут попадать на почву в результате применения удобрений, содержащих их соединения, а также промышленного загрязнения. Избыточные концентрации этих металлов в почве могут вызывать нарушения питательного режима растений, что приводит к снижению урожайности и качества сельскохозяйственных культур.
В целом, влияние щелочноземельных металлов на окружающую среду является серьезной проблемой. Это требует контроля и снижения выбросов этих металлов в окружающую среду, а также разработки методов очистки атмосферы, воды и почвы от загрязнений, вызванных деятельностью человека.
Вопрос-ответ

Какие элементы входят в главную подгруппу щелочноземельных металлов?
В главную подгруппу щелочноземельных металлов входят магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие свойства обладают щелочноземельные металлы?
Щелочноземельные металлы обладают такими свойствами, как низкая плотность, мягкость, низкая температура плавления и кипения, хорошая электропроводность и реактивность с водой. Они также образуют ионы с двойным положительным зарядом (М2+), что делает их хорошими агентами для образования солей.
Какие сферы применения имеют щелочноземельные металлы?
Щелочноземельные металлы имеют широкий спектр применения в различных областях. Например, магний используется в производстве сплавов, в технике, для изготовления легких сплавов, а также в производстве огнеупорных материалов. Кальций используется в производстве стали, стронций в различных химических процессах, барий в медицине и радий в радиотерапии и исследованиях ядерных реакций.
