Гидролиз солей щелочных металлов является важным процессом, который происходит при растворении этих солей в воде. Гидролиз - это реакция разложения вещества под действием воды. При гидролизе солей щелочных металлов ионы металла и ионы воды взаимодействуют, что приводит к образованию различных химических соединений.
Гидролиз солей щелочных металлов особенно важен для понимания поведения этих соединений в растворах. Реакция гидролиза может повлиять на растворимость солей, а также на их концентрацию и протекание других химических реакций. При гидролизе ион металла может выделяться из раствора в виде осадка или образовывать комплексы с ионами воды.
Применение гидролиза солей щелочных металлов находит широкое применение в различных областях, включая химическую промышленность, медицину и аналитику. Например, гидролиз некоторых солей щелочных металлов может использоваться для получения осадков с высокой степенью чистоты. Также гидролиз может служить методом анализа, позволяющим определить содержание ионов металлов в растворе.
Гидролиз солей щелочных металлов является сложным и многогранным процессом, который имеет большое значение в химической науке и индустрии. Изучение особенностей гидролиза солей щелочных металлов позволяет лучше понять их поведение в растворах и применить данную информацию в различных областях науки и технологии.
Гидролиз солей щелочных металлов: особенности и применение

Гидролиз солей щелочных металлов представляет собой химическую реакцию, при которой соль взаимодействует с водой, образуя гидроксид и кислоту или основание. Эта реакция происходит благодаря ионной природе солей щелочных металлов, таких как натрий, калий и литий. Гидролиз солей щелочных металлов имеет ряд особенностей.
Во-первых, гидролиз солей щелочных металлов происходит с образованием гидроксидного иона (OH-) и катиона, который может быть водородным (H+) или металлическим. Гидролиз металлического катиона приводит к образованию основания, а гидролиз водородного катиона - к образованию кислоты.
Во-вторых, гидролиз солей щелочных металлов может быть нейтральным, когда образующаяся кислота и гидроксид имеют равные концентрации и не влияют на pH среды. Также возможен гидролиз солей с кислотным или основным окрашиванием раствора в зависимости от концентраций кислоты и гидроксида.
Гидролиз солей щелочных металлов имеет применение в различных областях. Например, он используется в процессе производства щелочных металлов, расщепляя соли и образуя гидроксид. Также гидролиз применяется в химическом анализе для определения реактивности и рН растворов. Кроме того, гидролиз солей щелочных металлов играет важную роль в биологических процессах, таких как энзиматические реакции и обмен веществ.
Особенности гидролиза щелочных металлов

Гидролиз щелочных металлов – это химическая реакция, при которой соли щелочных металлов растворяются в воде и подвергаются специфическому разложению под влиянием воды. Гидролиз щелочных металлов происходит в результате взаимодействия между водой и ионами металла, содержащимися в соли.
Особенностью гидролиза щелочных металлов является то, что он происходит при образовании гидроксидов металлов и кислотных или основных остатков, в зависимости от кислотно-основного характера реагента. Таким образом, гидролиз приводит к изменению pH раствора, что оказывает влияние на его свойства и возможность применения.
Гидролиз щелочных металлов широко применяется в различных отраслях науки и техники. Например, в химической промышленности гидролиз используется для получения гидроксидов щелочных металлов, которые применяются в качестве основных компонентов в производстве щелочей, стекла, мыла и других продуктов.
В биологии и медицине гидролиз щелочных металлов играет важную роль, так как многие биологические процессы и реакции в организме человека зависят от pH среды. Поэтому изучение особенностей гидролиза щелочных металлов помогает понять и управлять этими процессами, а также разрабатывать новые методы диагностики и лечения заболеваний.
Механизм гидролиза солей щелочных металлов
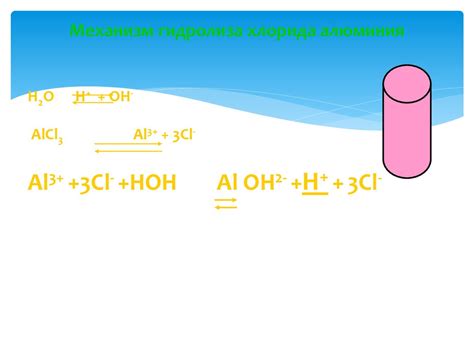
Гидролиз солей щелочных металлов – это процесс, при котором соли щелочных металлов (например, натрия, калия) взаимодействуют с водой, приводя к образованию кислоты или щелочи. Механизм гидролиза определяется ионным составом соли и величиной ее реакционной способности.
Гидролиз солей щелочных металлов можно разделить на две основные категории: гидролиз солей с катионами щелочных металлов и анионами слабых кислот, а также гидролиз солей с катионами слабых оснований и анионами сильных кислот.
В первом случае, при гидролизе соли с катионами щелочных металлов и анионами слабых кислот, происходит диссоциация воды, в результате которой ионы воды реагируют с ионами соли. Например, гидролиз хлорида натрия (NaCl) приводит к образованию щелочной реакции, так как OH- ионы взаимодействуют с Cl- ионами, образуя неустойчивую хлороводородную кислоту (HCl) и НО- ионы.
Во втором случае, при гидролизе соли с катионами слабых оснований и анионами сильных кислот, происходит взаимодействие ионов соли с ионами воды. Например, гидролиз ацетата натрия (CH3COONa) приводит к образованию кислотной реакции, так как Na+ и CH3COO- ионы взаимодействуют с H+ и ОН- ионами, образуя уксуснокислую кислоту (CH3COOH) и НО- ионы.
Знание механизма гидролиза солей щелочных металлов играет важную роль в аналитической химии, в процессе определения качественного и количественного состава веществ. Также это знание применяется в химии и биологии для понимания химических реакций, происходящих в растворах солей.
Эффекты гидролиза щелочных металлов

Гидролиз щелочных металлов, таких как натрий, калий и литий, является важным химическим процессом и влияет на свойства солей этих металлов. Гидролиз представляет собой химическую реакцию, при которой ионы металла вступают во взаимодействие с молекулами воды.
Один из эффектов гидролиза щелочных металлов заключается в изменении pH раствора. Ионы металла могут протекать в растворе гидролиз, образуя гидроксиды, кислоты или органические основания. Это может привести к изменению кислотности или щелочности раствора, что имеет значение для процессов, в которых участвует данная соль.
Гидролиз щелочных металлов также может влиять на растворимость солей. При гидролизе ионы металла могут связываться с ионами гидроксила или другими ионами растворителя, что может привести к образованию нерастворимых или малорастворимых соединений. Это свойство может быть использовано для осаждения или концентрирования ионов металла в растворе.
Гидролизщелочных металлов играет также важную роль в процессах катализа. Некоторые пары ионов металла и ионов гидроксила образуют стабильные комплексы, которые могут служить активными центрами катализаторов. Это может быть использовано в различных синтетических реакциях или промышленных процессах, таких как гидрогенирование, окисление и гидроксилирование.
Применение гидролиза солей щелочных металлов
Гидролиз солей щелочных металлов является важным процессом и используется в различных областях науки и промышленности. Одним из основных применений гидролиза является производство кислот или щелочей. При взаимодействии солей щелочных металлов с водой происходит отщелачивание или образование слабых кислотных растворов, которые могут быть использованы в различных процессах и технологиях.
Гидролиз солей также играет важную роль в области аналитической химии. Он используется для определения pH растворов и химических реакций. Например, при гидролизе солей щелочных металлов образуются гидроксиды металлов и соответствующие кислоты. Изменение pH раствора при гидролизе может быть измерено, что позволяет определить концентрацию и свойства солей.
Также гидролиз солей щелочных металлов применяется в процессе получения катализаторов. Гидролизные реакции могут помочь синтезировать специальные типы катализаторов, которые используются в различных химических процессах, таких как полимеризация или гидрогенирование. Это позволяет улучшить эффективность и скорость химических реакций.
Кроме того, гидролиз солей щелочных металлов имеет применение в производстве энергии. Гидролиз может быть использован для получения водорода, который затем можно использовать в качестве источника энергии. Водородный гидролиз является одним из наиболее эффективных способов производства водорода для использования в топливных элементах или других технологиях, основанных на водороде.
Перспективы исследования гидролиза солей щелочных металлов

Гидролиз солей щелочных металлов – это процесс, в результате которого вода разлагает соединения щелочных металлов на ионы гидроксида и катионы металла. Изучение этого процесса имеет большое значение для различных областей науки и техники. Возможности исследования гидролиза солей щелочных металлов обширны и обещают крупные прорывы в разных направлениях.
Одной из важных перспектив в исследовании гидролиза солей щелочных металлов является разработка новых катализаторов. Ионы щелочных металлов, образующиеся в результате гидролиза, обладают высокой активностью, что делает их привлекательным объектом исследований в области катализа.
Еще одной перспективой является применение гидролиза солей щелочных металлов в производстве наноматериалов. Известно, что некоторые металлы могут образовывать наночастицы с помощью гидролиза и последующего восстановления. Исследование этого процесса позволяет разрабатывать новые методы синтеза наночастиц и улучшать существующие.
Кроме того, изучение гидролиза солей щелочных металлов может привести к разработке новых материалов с определенными свойствами. Гидроксиды щелочных металлов широко используются в различных отраслях промышленности, и их свойства могут быть изменены с помощью гидролиза. Практическое применение таких материалов может быть обнаружено в области электроники, фотоники, керамики и других.
Таким образом, исследование гидролиза солей щелочных металлов имеет большой потенциал и перспективы. Развитие этой области позволит создать новые материалы и каталитические системы, а также улучшить существующие технологии. Исследования в этой области не только предоставят новые научные знания, но и помогут в развитии промышленности и различных областей науки.
Вопрос-ответ

Какой химический процесс происходит при гидролизе солей щелочных металлов?
Гидролиз солей щелочных металлов – это процесс реакции ионов металла с молекулами воды. В результате гидролиза образуются ионы гидроксидов металла и ионы водорода или гидроксона, в зависимости от pH среды.
Почему щелочно-металлические соли гидролизуются?
Щелочно-металлические соли обладают щелочным характером, поэтому они могут реагировать с водой. Это связано с тем, что ионы металла в щелочных солях обладают high x19+Electronegativity%">\end{math}, поэтому они способны присоединяться к водным молекулам и образовывать гидроксиды.
Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие факторы могут влиять на скорость гидролиза щелочно-металлических солей?
Скорость гидролиза щелочно-металлических солей может зависеть от таких факторов, как концентрация соли, температура реакции, pH среды и наличие катализаторов. Более низкое pH среды и более высокая температура обычно способствуют более быстрому гидролизу.
Где применяется гидролиз солей щелочных металлов?
Гидролиз солей щелочных металлов имеет множество применений. Например, гидролиз щелочных металлических солей может использоваться в процессе очистки воды, при производстве мыла и в качестве катализатора в органических реакциях. Также гидролиз может использоваться в лабораторных исследованиях и в химическом анализе.
