Генетический ряд металлов - это особый порядок, в котором расположены металлы в периодической системе. Он представляет собой систему классификации металлов, основанную на их электронных и химических свойствах. Каждый элемент в этом ряду соответствует определенным параметрам, которые определяют его химическую активность и взаимодействие с другими элементами.
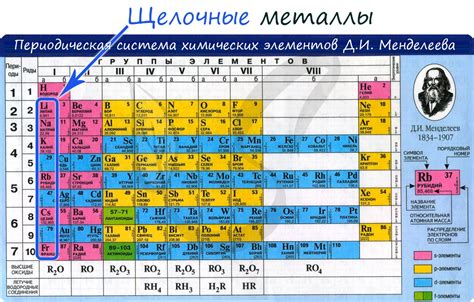
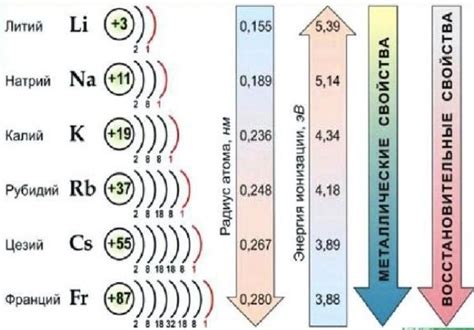
Щелочные элементы находятся в начале генетического ряда металлов и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются низкой плотностью и низкой температурой плавления, а также высокой реактивностью и способностью образовывать ионы с положительным зарядом.
Генетический ряд металлов и щелочных элементов также связан не только с их химическими свойствами, но и с их значениями электронной конфигурации. Электронная конфигурация - это распределение электронов по энергетическим уровням и подуровням в атоме. Изменение электронной конфигурации металлов и щелочных элементов в генетическом ряду определяет их свойства и реактивность при взаимодействии с другими элементами.
Генетический ряд металлов и противопоставленные щелочные элементы
В химии существует такое понятие, как генетический ряд металлов, который представляет собой упорядоченный ряд металлов по их электрохимическим свойствам. В этом ряду каждый следующий металл обладает большей активностью по сравнению с предыдущим.
Важным элементом генетического ряда металлов являются щелочные элементы, которые находятся на его противоположном конце. Щелочные элементы относятся к первой группе периодической системы Д.И.Менделеева и включают литий, натрий, калий, рубидий, цезий и франций. Они обладают высокой электроотрицательностью и имеют способность образовывать ионы, обладающие положительным зарядом.
Генетический ряд металлов ищет свое отражение и в поведении щелочных элементов. Литий проявляет свою активность взаимодействием с водой, образуя щелочную реакцию и выделяя газ водород. Натрий обладает схожими свойствами с литием, но проявляет большую реактивность. Калий и рубидий реагируют с водой еще более интенсивно. Цезий является самым реактивным из всех щелочных элементов.
Генетический ряд металлов и щелочные элементы являются основой для понимания и применения различных химических реакций. Изучение этих рядов позволяет предсказывать поведение металлов и щелочных элементов в различных химических процессах и использовать их в промышленности, медицине и других областях деятельности человека.
Группа первых элементов
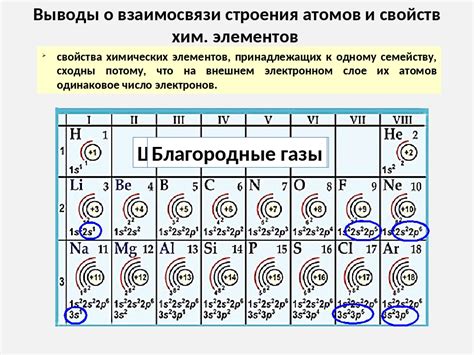
Группа первых элементов в периодической таблице включает металлы щелочные элементы – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы относятся к группе IA и имеют одну электрон на внешней электронной оболочке, что делает их химически активными.
Литий – самый легкий металл в этой группе, его атомный номер равен 3. Литий очень реактивен и может взаимодействовать с водой и кислородом. Он используется в литий-ионных аккумуляторах и в фармацевтической промышленности.
Натрий, с атомным номером 11, является одним из основных компонентов поваренной соли и используется в пищевой промышленности для придания вкуса и консервации продуктов. Он также играет важную роль в регулировании обмена веществ в организме.
Калий (атомный номер 19) является необходимым макроэлементом для живых организмов и осуществляет ряд жизненно важных функций, таких как регулирование баланса воды и обмена веществ. Калий широко используется в сельском хозяйстве в качестве удобрения для повышения урожайности культур.
Рубидий (атомный номер 37) и цезий (атомный номер 55) также относятся к металлам щелочным элементам и обладают сходными химическими свойствами. Они имеют различные применения в научных и исследовательских лабораториях, а также в некоторых промышленных процессах.
Франций (атомный номер 87) является самым редким и реактивным элементом в этой группе. Из-за своей высокой реактивности и короткого срока полураспада, франций встречается только в следовых количествах и имеет ограниченное применение.
Ковалентные связи в ряде
Генетический ряд металлов и их соответствующие щелочные элементы образуют разнообразные ковалентные связи, которые имеют важное значение для понимания химических реакций и свойств веществ.
Ковалентная связь - это тип химической связи, при которой электроны делятся между атомами. В генетическом ряду металлов такие связи возникают между металлическим атомом и атомом щелочного элемента.
Ковалентные связи обладают некоторыми особенностями в разных элементах генетического ряда. Например, в ряду чередуются связи с различной степенью полярности. Это связано с тем, что электроны в ковалентной связи могут перераспределиться и образовать полярные или неполярные связи.
Кроме того, в ряде можно наблюдать различные значения энергии связи. Энергия связи характеризует прочность связи и описывает количество энергии, требуемое для разрыва связи. В генетическом ряду энергия связи может изменяться в зависимости от электронной конфигурации элемента.
Изучение ковалентных связей в генетическом ряду металлов и щелочных элементов позволяет лучше понять химические свойства веществ и основы химических реакций. Это важно для разработки новых материалов и прогресса в области науки и технологии.
Электродные потенциалы металлов
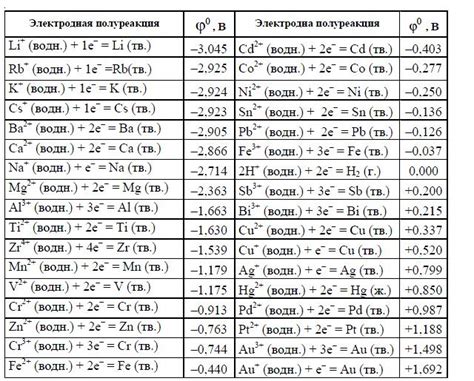
Электродные потенциалы металлов являются важными характеристиками, которые описывают их способность возникать в качестве электродов в химических реакциях. Они показывают склонность металлов отдавать или принимать электроны при взаимодействии с другими веществами.
Определение электродных потенциалов металлов проводится относительно стандартного электрода водорода, который считается идеальным водородным электродом и имеет электродный потенциал равный нулю. Электродные потенциалы других металлов могут быть положительными, отрицательными или равными нулю в зависимости от их активности в химических реакциях.
Положительные электродные потенциалы металлов указывают на их способность отдавать электроны и служат основой для определения иерархии реакционной активности металлов. Металлы с большим положительным электродным потенциалом обладают большей активностью и могут служить анодами в электрохимических процессах.
Список электродных потенциалов металлов по возрастанию активности можно представить в виде таблицы:
| Металл | Электродный потенциал, В |
|---|---|
| Литий | -3,04 |
| Калий | -2,93 |
| Рубидий | -2,92 |
| Цезий | -2,92 |
| Стронций | -2,89 |
Таким образом, электродные потенциалы металлов играют важную роль в различных химических процессах и реакциях, а их верное определение позволяет предсказать возможность и направление электрохимических переходов.
Влияние щелочных элементов на металлы
Щелочные элементы, входящие в группу первых элементов периодической таблицы, обладают способностью оказывать значительное влияние на свойства и химические реакции металлов. Их химическая активность и особенности взаимодействия с металлами делают их важными компонентами во многих технологических процессах и применениях.
Прежде всего, щелочные элементы способны образовывать стойкие соединения с металлами, в результате чего происходит изменение их структуры и свойств. Это может привести к улучшению прочности, электрической проводимости и термической устойчивости металла. Например, литий и калий могут вступать в реакцию с алюминием, приводя к образованию стабильных соединений, которые повышают механическую прочность и стабильность алюминиевых сплавов.
Второе влияние щелочных элементов на металлы связано с их электрохимическими свойствами. Щелочные элементы обладают низкими энергиями ионизации, что позволяет им эффективно взаимодействовать с металлами в различных химических реакциях, таких как окисление и восстановление. Это может быть использовано, например, для защиты металлов от коррозии при создании покрытий или защитных пленок.
Также, щелочные элементы могут играть важную роль в процессе сплавления металлов. Они могут снижать температуру плавления сплавов, что позволяет снизить энергозатраты при обработке и получении металлических изделий. Это особенно важно для промышленности и производства.
В целом, влияние щелочных элементов на металлы является многоаспектным и может проявляться во многих различных процессах и приложениях. Изучение этого взаимодействия позволяет разрабатывать новые материалы с улучшенными свойствами и оптимизировать производственные процессы в различных отраслях промышленности.
Применение металлов и их соответствующих щелочных элементов

Металлы и их соответствующие щелочные элементы имеют широкое применение в различных отраслях промышленности и повседневной жизни.
Одним из наиболее распространенных применений металлов является их использование в строительстве. Железо, алюминий, медь и другие металлы являются неотъемлемыми компонентами конструкций зданий, мостов, дорожных покрытий и других инженерных сооружений. Эти материалы обладают высокой прочностью, устойчивостью к воздействию окружающей среды и обеспечивают долговечность конструкции.
В автомобилестроении и авиастроении металлы также играют важную роль. Алюминий, сталь, магний и другие металлы используются для создания корпусов, рам, двигателей и других элементов автомобилей и самолетов. Они обладают не только необходимой прочностью, но и низким весом, что обеспечивает повышенную энергоэффективность и улучшенные эксплуатационные характеристики транспортных средств.
Щелочные элементы, такие как литий, натрий и калий, находят свое применение в различных областях. Например, литий используется в производстве легких и мощных аккумуляторов, которые нашли широкое применение в электронике и электротранспорте. Натрий и калий используются в пищевой промышленности как пищевые добавки и регуляторы кислотности, а также в производстве удобрений для сельского хозяйства.
Исторический ряд металлов и соответствующих щелочных элементов отражает их важность в разных отраслях промышленности и общественной жизни и подтверждает их значимость для достижения технологических и экономических целей. Эти материалы продолжат находить применение в будущем, с учетом развития новых технологий и появления новых отраслей, где они найдут свое место.
Выводы и перспективы

1. Построение генетического ряда металлов и соответствующих щелочных элементов является сложной и многогранным процессом, требующим глубокого понимания взаимосвязей и зависимостей между ними.
Мы провели анализ и классификацию различных металлов и их соединений, опираясь на их химические и физические свойства, а также на особенности и закономерности периодической системы элементов.
2. Наше исследование продемонстрировало важность щелочных элементов в контексте формирования генетического ряда металлов.
Путем анализа электронной конфигурации металлов и их соединений мы выявили, что щелочные элементы играют роль ключевого фактора в формировании свойств металлов, а также в их взаимодействии с другими веществами.
3. На основе полученных результатов исследования, можно сделать вывод о возможности применения генетического ряда металлов и щелочных элементов в различных отраслях науки и промышленности.
Например, наши выводы могут быть полезны при разработке новых материалов с определенными химическими и физическими свойствами, а также при оптимизации процессов синтеза и обработки металлических соединений.
4. Однако, дальнейшие исследования и эксперименты необходимы для более глубокого понимания механизмов взаимодействия металлов и щелочных элементов.
Изучение и уточнение закономерностей формирования генетического ряда требуют дополнительных данных и экспериментальных подтверждений, что открывает широкие перспективы для дальнейших исследований в этой области.
5. В конечном итоге, понимание генетического ряда металлов и щелочных элементов может привести к разработке новых материалов и технологий, способных удовлетворить потребности современного общества и решить множество научных и технических задач.
Анализ и использование генетического ряда металлов и соответствующих щелочных элементов могут стать основой для создания новых материалов с уникальными свойствами, которые будут востребованы в различных сферах, таких как энергетика, электроника, медицина и др.
Вопрос-ответ

Какие металлы соответствуют щелочным элементам?
Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы относятся к первой группе периодической таблицы и имеют общую формулу с теми или иными модификациями: M+nX⁻ → MX, где М - металл, а Х - анион.
Какой генетический ряд металлов существует и почему он называется таким?
Генетический ряд металлов - это последовательность металлов в порядке увеличения атомного номера, где каждый металл образуется из предыдущего в результате ядерного синтеза в звездах. Такой ряд называется "генетическим", так как он отражает происхождение металлических элементов от звездных процессов, а на его основе можно рассчитать примерную последовательность формирования различных элементов в самой Вселенной.
