Литий – это металл из группы щелочных металлов, который имеет атомный номер 3 в периодической системе элементов. Этот легкий металл обладает низкой плотностью и высокой химической реактивностью. Он впервые был открыт в 1817 году и с тех пор нашел широкое применение в различных отраслях промышленности. Однако, его наиболее интересное свойство – это его влияние на живые организмы.
Генетический код лития означает, что этот металл способен взаимодействовать с живыми клетками и оказывать влияние на их функции. Он может влиять на обмен веществ, белковый синтез, структуру клеточных мембран и даже на экспрессию генов. Считается, что литий может иметь положительный эффект на центральную нервную систему, поэтому он широко используется в медицине как препарат для лечения психических расстройств.
Оксид лития (Li2O) – это химическое соединение лития с кислородом. Он имеет высокую температуру плавления и образует белый кристаллический порошок. Оксид лития обладает высокими электрохимическими свойствами и находит применение в производстве литиевых ионных аккумуляторов, которые широко используются в современной электронике. Кроме того, оксид лития применяется в стекольной промышленности в качестве составной части стекловолокна и в керамической промышленности для производства электролитических мембран.
Металлоосновные соли лития – это соединения, которые образуются в результате растворения оксида лития в воде или других растворителях. Они представляют собой соли, в состав которых входят ионы лития и анионы других элементов. Металлоосновные соли лития находят широкое применение в различных отраслях промышленности, включая производство лекарственных препаратов, стекла, керамики и электролитических растворов для аккумуляторов.
История открытия и свойства лития

Литий, первый элемент в группе щелочных металлов, был открыт в 1817 году английским физиком Сэром Артуром Смитсоном. Он обнаружил литий в минерале петалите и назвал его в честь греческого слова "λίθος", что означает "камень".
Литий - легкий и химически активный металл, он имеет атомный номер 3 и химический символ Li. Его атомная масса составляет примерно 6,94 г/моль. Литий является мягким металлом серебристо-белого цвета с низкой плотностью.
Одно из основных свойств лития - его высокая реакционность с водой. При контакте с водой литий выделяет водородный газ и образует щелочной гидроксид. Кроме того, литий обладает высокой плотностью энергии, что делает его ценным элементом в производстве литиевых ионных аккумуляторов, используемых в электронике и электромобилях.
Литий также используется в производстве алюминиевых сплавов, стекловарении, керамике и фармацевтике. Он обладает хорошей теплопроводностью и высокой температурой плавления, что делает его полезным в различных промышленных приложениях.
Способность лития образовывать соединения с кислородом делает его важным компонентом в производстве литиевых батарей. Они обладают высокой энергоемкостью, длительной жизненным циклом и низким саморазрядом. Литий также используется в лекарствах для лечения биполярного расстройства и других психических заболеваний.
Физические свойства металла

Металл - это вещество, обладающее определенными физическими свойствами. Оно обычно имеет металлический блеск и характеризуется высокой теплопроводностью и электропроводностью. Также металлы характеризуются высокой пластичностью и прочностью.
Высокая теплопроводность - одно из главных физических свойств металлов. Они обладают способностью эффективно проводить тепло. Это связано с особенностями устройства и связей в металлической структуре. Благодаря этому свойству, металлы широко применяются в производстве теплообменных элементов, проводников тепла и других устройств.
Высокая электропроводность также является важной характеристикой металлов. Они обладают способностью эффективно проводить электрический ток благодаря свободному перемещению электронов внутри своей структуры. Это позволяет использовать металлы для изготовления проводов, контактов и других элементов электрических устройств.
Одной из особенностей металлов является пластичность. Они могут быть легко деформированы и принимать различные формы без теряния своих основных свойств. Благодаря этому, металлы широко используются в производстве различных изделий, начиная от строительных конструкций до мелких деталей для механизмов.
Прочность является также важным физическим свойством металлов. Они обладают высокой прочностью, что позволяет им выдерживать большие нагрузки без разрушения. Это свойство делает их незаменимыми материалами для строительства и создания прочных конструкций.
Таким образом, металлы обладают рядом характерных физических свойств, которые определяют их широкое применение в различных отраслях промышленности и повседневной жизни.
Процесс образования литиевого оксида и его свойства

Литиевый оксид (Li2O) образуется в результате воздействия кислорода на металлический литий. При этом происходит окисление металла до формы Li+ и образуется оксидный ион O2-. Молекула литиевого оксида состоит из двух ионов лития и одного иона кислорода: Li2O.
Литиевый оксид является твердым белым веществом с кристаллической структурой. Он практически нерастворим в воде, но растворим в кислотах, образуя с ними соли лития. Литиевый оксид хорошо растворим в некоторых органических растворителях, таких как эфир и ацетон.
Литиевый оксид обладает амфотерными свойствами. Это означает, что он может реагировать как с кислотами, так и с основаниями. При взаимодействии с кислотами он образует соли, например LiCl, LiNO3, а с основаниями – гидроксид или альтернативное соединение. Благодаря этим свойствам, литиевый оксид может использоваться как растворитель в различных процессах химической синтеза и в производстве стекла и керамики.
Интересной особенностью литиевого оксида является его использование в качестве катализатора в реакциях окисления и дегидрирования органических соединений. Кроме того, литиевый оксид широко применяется в энергетике, в особенности в производстве литиевых батарей, где он служит как один из активных компонентов в качестве положительного электрода.
Применение лития в металлоосновных солях
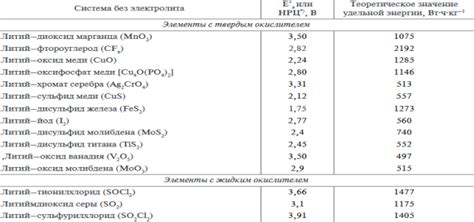
Литий – легкий химический элемент, который обладает рядом уникальных свойств, что делает его ценным для использования в различных отраслях науки и промышленности. В частности, литий широко применяется в производстве металлоосновных солей, которые имеют широкий спектр применения.
Металлоосновные соли, содержащие литий, являются важными компонентами в производстве взрывчатых веществ, таких как пиротехнические и военные материалы. Литиевые соли в данном случае используются для придания нужных химических свойств и стабилизации соединений.
Кроме того, металлоосновные соли лития находят применение в электрохимической промышленности. Они используются в аккумуляторах с высокой энергетической плотностью, таких как аккумуляторы литиево-ионного типа. Литиевые ионы обеспечивают высокую производительность и длительное время работы аккумуляторов, поэтому они широко применяются в мобильных устройствах, электромобилях и других современных технологиях.
Помимо этого, металлоосновные соли лития используются в производстве лекарственных препаратов. Литиевые препараты широко применяются в психиатрии для лечения расстройств настроения, таких как биполярное аффективное расстройство. Они помогают стабилизировать настроение и улучшают эмоциональное состояние пациентов.
Таким образом, применение лития в металлоосновных солях имеет широкие перспективы и находит свое применение во многих отраслях промышленности, науки и медицины.
Классификация металлоосновных солей с литием по строению
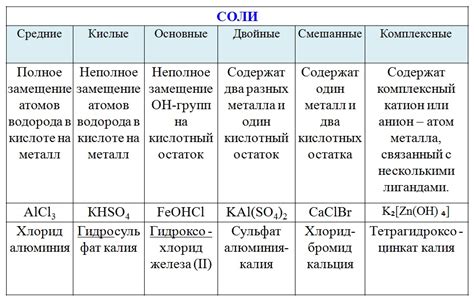
Металлоосновные соли с литием могут быть классифицированы по строению на несколько групп, в зависимости от атомной структуры и способа организации ионов в решетке.
Одним из классов металлоосновных солей с литием являются бинарные соединения. В этих соединениях литий образует ионный комплекс с другим металлом, например, хлорид лития (LiCl) или оксид лития (Li2O). Такие соединения имеют простую ионную решетку, в которой литиевые ионы и ионы другого металла расположены поочередно.
Другой класс металлоосновных солей с литием включает в себя комплексные соединения. В этих соединениях литий образует координационные связи с различными лигандами, образуя так называемые комплексы. Примером такого соединения может быть ацетат лития (LiC2H3O2), где литий связан с ацетатными и H3O+ ионами через кислородные атомы. Комплексные соединения также могут образовывать более сложные структуры, включающие полинуклиды и кластеры.
Еще одним классом металлоосновных солей с литием являются соли с полимерными структурами. В этих соединениях ионы лития образуют трехмерные полимерные сети, связанные между собой через атомы кислорода или другие ионы. Примером такого соединения является литий полиоксалат (Li2C2O4), где ионы лития образуют бесконечную цепочку через кислородные атомы оксалатных групп.
Химические свойства металлоосновных солей с литием
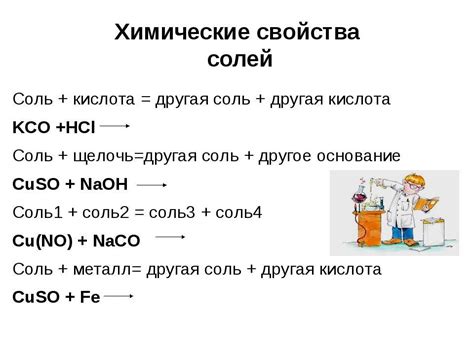
Металлоосновные соли с литием обладают рядом химических свойств, которые делают их важными соединениями в различных областях химии и промышленности.
1. Кислотные свойства: Литий образует сильные основания, поэтому металлоосновные соли с литием проявляют кислотные свойства. Они способны реагировать с кислотами, образуя соли и воду. Такие реакции часто применяются в химическом анализе для определения содержания кислот в образцах.
2. Растворимость: Многие металлоосновные соли с литием хорошо растворимы в воде, образуя прозрачные растворы. Они также могут образовывать комплексы с различными лигандами, что позволяет использовать их в качестве катализаторов, синтеза и в других процессах.
3. Электрохимические свойства: Литий имеет низкое электродное потенциал, поэтому металлоосновные соли с литием используются в электрохимии. Они способны электрохимически взаимодействовать с другими веществами и участвовать в различных реакциях, таких как электролиз и батарейные процессы.
4. Теплостойкость: Металлоосновные соли с литием обладают хорошей теплостойкостью, что делает их полезными в высокотемпературных процессах, например, при производстве керамики и световых материалов. Они также используются в специализированных печах и плавильных печах.
Применение металлоосновных солей с литием в промышленности
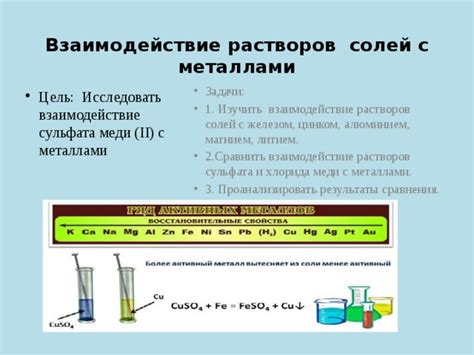
Металлоосновные соли с литием широко используются в промышленности благодаря своим уникальным свойствам и химической стабильности. Они используются в различных отраслях, включая электроэнергетику, атомную промышленность, химическую промышленность и многие другие.
Одно из важных применений металлоосновных солей с литием - это использование в электроэнергетике. Литий-ионные аккумуляторы, работающие на основе этих солей, обладают высокой энергоемкостью и длительным сроком службы. Они широко применяются в мобильной электронике, автомобильной промышленности и других сферах, где требуется надежный и эффективный источник энергии.
В атомной промышленности металлоосновные соли с литием используются для стабилизации радиоактивных элементов и предотвращения их распространения. Они также могут использоваться в процессах разделения и очистки ядерных материалов.
В химической промышленности металлоосновные соли с литием используются как катализаторы и сырье для производства различных органических и неорганических соединений. Они также могут быть использованы для создания специализированных покрытий и материалов, обладающих определенными электрохимическими свойствами.
В общем, применение металлоосновных солей с литием в промышленности позволяет создавать новые материалы и технологии, которые не только повышают эффективность процессов, но и обеспечивают экологическую безопасность. Исследования и разработка новых применений этих соединений продолжаются, открывая просторы для развития новых отраслей и улучшения существующих.
Вопрос-ответ

Каковы основные свойства лития в металлической форме?
Литий - легкий металл с атомным номером 3 в периодической таблице. Он обладает низкой плотностью, низкой температурой плавления и высокой электропроводностью. Также литий является очень реактивным металлом и легко реагирует с водой и кислородом.
Каким образом литий используется для создания металлоосновных солей?
Литий используется для создания металлоосновных солей путем растворения его в соответствующих кислотах. Например, растворение литиевого гидроксида в серной кислоте приводит к образованию сульфата лития. Такие металлоосновные соли могут использоваться в различных областях, включая фармацевтику и электронику.
Каким образом литий преобразуется в оксидный вид?
Преобразование лития в оксидный вид может быть достигнуто путем нагрева металлического лития в кислородной среде. При этом образуется литиевый оксид (Li2O), который является бесцветным твёрдым веществом. Литиевый оксид широко используется в производстве литиевых аккумуляторов и других электронных компонентов.
