Генетические ряды металлов – это упорядоченные по возрастанию или убыванию химических свойств химические элементы, которые могут быть разделены на группы схожих свойств. Эти генетические ряды позволяют увидеть закономерности в строении атомов и влиянии их электронной структуры на свойства металлов. Какая-либо особенность, например, электропроводность, может меняться по мере перемещения по генетическому ряду – от исключительно непроводящих до чрезвычайно проводящих.
Одним из известных и рассмотренных генетических рядов металлов является ряд щелочных металлов, таких как литий, натрий и калий. Эти металлы обладают сходными свойствами, такими как низкая плотность, мягкость и способность реагировать с водой. Важность ряда щелочных металлов заключается в их широком использовании в различных сферах, включая производство батареек, лекарств, стекла и жидких ракетных топлив.
Другим примером генетического ряда металлов является ряд переходных металлов, включающий элементы, такие как железо, никель и медь. Эти металлы имеют схожие свойства, такие как высокая твердость и способность образовывать различные структуры со сложными физическими и химическими свойствами. Ряд переходных металлов играет важную роль в промышленности, благодаря своим специфическим свойствам, используемым в различных технологических процессах, включая производство стали, катализ реакций и электронных устройств.
Генетические ряды металлов помогают нам понять и классифицировать элементы, а также использовать их в нашей повседневной жизни и в различных сферах технологии. Знание этих рядов позволяет ученым создавать новые материалы и улучшать существующие, что способствует развитию науки и промышленности.
Таким образом, генетические ряды металлов играют важную роль в химии и материаловедении, позволяя нам лучше понять свойства и применение металлов. Они являются основой для наших знаний об элементах и помогают нам прогнозировать свойства новых материалов. Использование генетических рядов металлов может привести к разработке новых технологий и материалов, которые могут улучшить наши жизни и сделать мир лучше и безопаснее.
Генетические ряды металлов: что это такое?
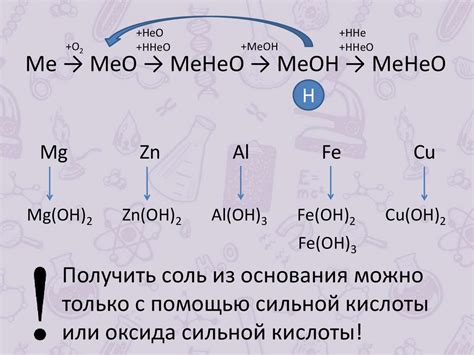
Генетические ряды металлов - это систематическая классификация металлов по их свойствам и химической активности. В такой классификации металлы располагаются в порядке увеличения их активности, начиная с самых реактивных и заканчивая наименее реактивными. Это позволяет установить определенные закономерности в химическом поведении металлов и предсказать их реакционную способность.
Генетические ряды металлов называют также электрохимическими рядами, так как они основаны на электродном потенциале металлов. Электродный потенциал - это способность металла отдавать или принимать электроны при реакции окисления или восстановления. Чем выше электродный потенциал металла, тем более активным он является и тем легче он окисляется.
Важность генетических рядов металлов заключается в том, что они позволяют предсказывать образование и течение химических реакций. Например, если знать положение металла в генетическом ряду, можно сказать, будет ли он реагировать с кислородом или солями, образовывать соединения со свинцом или ртутью и т.д. Также генетические ряды металлов широко используются в области электрохимии, металлургии и других отраслях, связанных с изучением и применением металлов.
Примеры генетических рядов металлов

1. Ряд активности металлов: Этот генетический ряд располагает металлы по их способности вступать в химические реакции. В его верхней части находятся самые активные металлы, такие как литий и натрий, которые легко реагируют с водой и воздухом. В нижней части ряда находятся металлы, которые не реагируют с водой или воздухом, например, золото и платина.
2. Ряд металлов, упорядоченных по электрохимическому потенциалу: Этот генетический ряд показывает, как металлы реагируют в электролитических процессах. Металлы в верхней части ряда имеют большее электрохимическое потенциал, что делает их более активными в реакциях окисления. Например, металлы, такие как цинк и алюминий, способны образовывать ионные соединения в процессе коррозии.
3. Ряды металлов по свойствам сопротивления проводимости: Этот генетический ряд упорядочивает металлы по их способности проводить электрический ток. Металлы, такие как медь и алюминий, находятся в верхней части ряда и являются хорошими проводниками электричества, в то время как металлы, такие как свинец и железо, находятся в нижней части ряда и имеют более низкую проводимость.
4. Ряд абсолютной активности металлов: Этот генетический ряд располагает металлы по их способности вытеснять друг друга из растворов и соединений. Металлы, находящиеся в верхней части ряда, могут вытеснить металлы, находящиеся в нижней части ряда, из их соединений. Например, цинк имеет более высокую абсолютную активность, чем медь, поэтому цинк может вытеснить медь из ее соединений.
Все эти генетические ряды металлов являются важным инструментом для понимания и прогнозирования химических свойств металлов. Они позволяют установить иерархию металлов по их свойствам и использовать эту информацию в различных промышленных и научных приложениях, в том числе при разработке новых материалов и сплавов.
Ряд активности металлов

Ряд активности металлов представляет собой упорядоченный список металлов по их способности реагировать с водой и кислотами. Чем выше в ряду находится металл, тем большую активность он проявляет.
Первое место в ряду активности занимает литий. Этот металл очень реактивен и быстро реагирует с водой, образуя гидроксид лития и выделяя водород. Литий используется в множестве промышленных процессов, а также в производстве легких металлических сплавов.
Второе место в ряду занимает калий. Также как литий, калий реагирует с водой, образуя гидроксид калия и выделяя водород. Калий широко применяется в сельском хозяйстве и в производстве удобрений.
Далее в ряду идут натрий, кальций, магний, алюминий и так далее. Эти металлы все имеют различную степень реактивности, что делает их полезными в различных отраслях промышленности.
Ряд активности металлов является важным для понимания и использования свойств металлов. Этот ряд позволяет определить, какие металлы могут использоваться в различных химических реакциях и процессах.
Изучение ряда активности металлов имеет большое значение в области химии и материаловедения, и позволяет оптимизировать процессы производства и выбор материалов для различных целей.
Ряд реактивности металлов
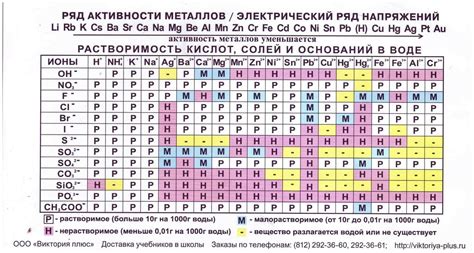
Ряд реактивности металлов описывает их способность вступать в химические реакции, основываясь на их электрохимическом потенциале. Чем выше металл на ряду реактивности, тем большую активность он проявляет.
Наиболее активными металлами на ряду реактивности являются щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Они легко реагируют с водой и кислородом, образуя щелочные гидроксиды и оксиды. Щелочные металлы имеют положительный электрохимический потенциал и, следовательно, сильную способность отдавать электроны.
Другими активными металлами на ряду реактивности являются алюминий, цинк, железо и медь. Эти металлы реагируют с кислотами, образуя соответствующие соли. Однако их реактивность ниже, чем у щелочных и щелочноземельных металлов.
В конце ряда реактивности находятся темные металлы, такие как свинец, серебро и золото. Они практически не реагируют с большинством химических веществ и обладают очень низкой степенью активности.
Знание ряда реактивности металлов является важным с практической точки зрения. Оно позволяет предсказать, какие металлы смогут заменять друг друга в химических реакциях и электролизе. Также ряд реактивности металлов используется для определения живучести и коррозионной стойкости материалов, а также в процессе защиты металлических конструкций от коррозии.
Ряд электрохимической активности металлов

Ряд электрохимической активности металлов - это упорядоченный список металлов по их способности вступать в реакцию с растворами электролитов. Металлы, находящиеся выше в ряду, обладают большей активностью и более легко окисляются, тогда как металлы, находящиеся ниже, имеют меньшую активность и являются более неподвижными.
В ряду электрохимической активности металлы располагаются в порядке убывания их стандартного потенциала окисления. Наиболее активные металлы, такие как литий, натрий и калий, находятся вверху ряда, а наименее активные, такие как золото, платина и свинец, находятся внизу.
Ряд электрохимической активности металлов имеет большое практическое значение. Он используется для определения возможности реакции между металлами и растворами электролитов, а также для определения направления потока электронов в электрохимических процессах. Также ряд активности металлов определяет возможность коррозии материалов и используется в процессах обработки металлов, гальванического покрытия и создания электрохимических элементов.
- Активные металлы в ряду электрохимической активности обладают большей способностью к окислению и являются хорошими восстановителями.
- Металлы, находящиеся в середине ряда активности, могут быть как окислителями, так и восстановителями в зависимости от условий реакции.
- Металлы, находящиеся внизу ряда, имеют меньшую активность и обычно выступают в реакциях в качестве окислителей.
Таким образом, ряд электрохимической активности металлов является важным инструментом для понимания реакций, связанных с электрохимией, и широко применяется в различных областях, связанных с металлургией и химией.
Ряд положительных скачков резистивности

Ряд положительных скачков резистивности – это последовательность элементов, где каждый следующий элемент обладает большей резистивностью, чем предыдущий. Этот ряд является одним из важных инструментов при исследовании физических свойств металлов и сплавов.
Положительные скачки резистивности возникают в результате изменения состояния поверхности металла или сплава, а также изменения его микроструктуры. Эти изменения могут быть вызваны такими факторами, как внешняя температура, агрессивная окружающая среда или механическое воздействие.
Изменение резистивности материала ведет к изменению его электрических свойств, таких как проводимость, сопротивление и др. Положительные скачки резистивности могут быть использованы для контроля качества металлов и сплавов, а также для определения их физических характеристик, таких как структура, состав и твердость.
Для измерения ряда положительных скачков резистивности применяют различные методы, включая электрические и магнитные методы. Эти методы позволяют получить числовые значения для каждого элемента ряда, что дает возможность провести анализ и сравнение полученных данных.
Ряд атомных ионных радиусов металлов

Атомные ионные радиусы являются одним из важных свойств металлов, определяющих их химические свойства и возможности взаимодействия с другими веществами. Ряд атомных ионных радиусов позволяет сравнивать металлы по их размеру и относительной величине.
Атомные радиусы металлов, как правило, увеличиваются по мере движения вдоль периодической таблицы от верхнего левого угла (лития) к нижнему правому углу (франция). Это связано с добавлением электронных оболочек и увеличением числа протонов в ядре атома, что ведет к увеличению размеров атома.
Ионные радиусы металлов также следуют аналогичной тенденции - размер ионов увеличивается с увеличением электролитического заряда. Например, ионы металлов в форме M+ имеют меньший радиус, чем ионы металлов в форме M2+. Это связано с увеличенным количеством протонов и облегченным отталкиванием между электронными облаками ионов с большим зарядом.
Значение ряда атомных ионных радиусов металлов заключается в его приложении для предсказания и анализа соединений и реакций между металлами и другими веществами. Большие радиусы, например, могут указывать на возможность образования ионного соединения с другими элементами, в то время как маленькие радиусы могут свидетельствовать о возможности образования ковалентного соединения или сложных структур.
Информация о ряде атомных ионных радиусов металлов используется в химии, металлургии, в материаловедении и во многих других областях науки и техники, где требуется понимание свойств и взаимодействия металлов с другими веществами.
Ряд распределения металлов в земной коре
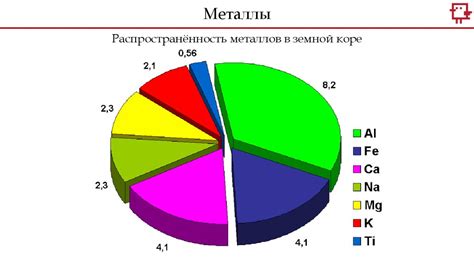
Ряд распределения металлов в земной коре отображает присутствие и концентрацию различных металлов в земле. Этот ряд является важным инструментом для изучения геологических процессов и поиска полезных ископаемых.
Некоторые из основных металлов, присутствующих в земной коре, включают железо, алюминий, магний, калий и натрий. Железо является самым распространенным и значимым металлом в земной коре, используемым в различных отраслях, от строительства до производства стали.
Другие металлы, обнаруженные в земной коре, такие как медь, свинец, цинк и никель, играют важную роль в промышленности. Медь, например, широко используется в электротехнике и строительстве, а цинк используется в производстве литейных сплавов и защитных покрытий.
Некоторые редкие металлы, такие как золото, серебро и платина, имеют высокую стоимость и используются в ювелирном и электронном производстве. Они встречаются в земной коре в небольших количествах, но их добыча и использование имеют большую экономическую значимость.
Изучение распределения и концентрации металлов в земной коре позволяет предсказывать места нахождения рудных месторождений и оптимизировать процессы добычи полезных ископаемых. Также это направление исследования позволяет более глубоко понять геологические процессы, протекающие в земле.
Ряд степеней окисления металлов

Ряд степеней окисления металлов представляет собой порядок, в котором металлы образуют ионы с различными степенями окисления. Этот ряд является важным инструментом в химии, поскольку позволяет предсказать, какие ионы могут быть образованы данным металлом.
На основании ряда степеней окисления можно определить возможность реакции между металлом и кислородом, а также предсказать продукты реакции в случае, если ион с наивысшей степенью окисления образуется. Степень окисления металла в ионе зависит от его электроотрицательности и электронной конфигурации.
Ряд степеней окисления металлов имеет определенную последовательность, которая может быть выражена числовыми значениями или с помощью обозначений. Например, для железа существуют ионы Fe2+ и Fe3+, где обозначение со знаком "+" указывает на степень окисления. В ряду степеней окисления, железо находится после металлов, у которых степень окисления меньше, и до металлов, у которых степень окисления выше.
Знание ряда степеней окисления металлов является необходимым для понимания различных химических реакций, особенно в области органической и неорганической химии. Это позволяет прогнозировать продукты реакций, определять возможность окислительно-восстановительных процессов и проводить анализ химических соединений.
Вопрос-ответ

Какие генетические ряды металлов существуют?
Существуют несколько генетических рядов металлов: активные металлы, полуметаллы, переходные металлы и благородные металлы.
Какова значимость генетических рядов металлов?
Генетические ряды металлов имеют большую значимость в области химии и материаловедения. Они позволяют классифицировать металлы по их свойствам и химической активности, что является важным для понимания и изучения химических реакций и создания новых материалов с определенными свойствами.
