Гальванический элемент - это электрохимическая система, состоящая из двух полунаправленных металлических электродов, погруженных в электролит и разделенных промежуточной средой. При наличии электрической связи между электродами, происходит перенос электронов через внешнюю цепь, что приводит к возникновению электрического тока. При этом электрод, который отдает электроны, называется анодом, а электрод, принимающий электроны, - катодом.
Электродные потенциалы - это мера способности металла образовывать ион и отдавать электроны. Это важное понятие электрохимического ряда напряжений металлов, который определяет порядок их активности в гальваническом элементе. Металл с более высоким электродным потенциалом имеет большую склонность отдавать электроны и выступает в качестве анода, тогда как металл с более низким потенциалом принимает электроны и является катодом.
Электродные потенциалы металлов могут быть измерены относительно стандартного водородного электрода (SHE). В этом случае потенциалы металлов выражаются в относительных единицах - вольтах (В). Например, электродный потенциал цинка (-0,76 В) означает, что цинк имеет большую склонность отдавать электроны, чем водород, который имеет стандартный электродный потенциал 0 В.
Знание электродных потенциалов металлов необходимо для понимания и прогнозирования реакций окислительно-восстановительных процессов, а также для выбора электродов при создании гальванических элементов и других электрохимических систем.
Гальванический элемент: основные принципы работы
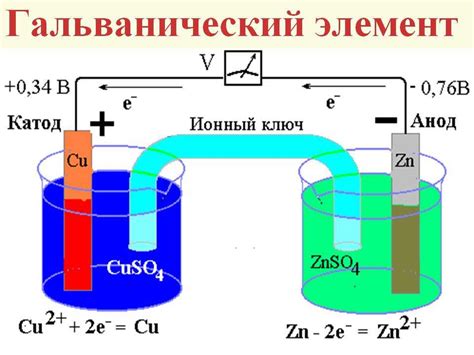
Гальванический элемент – это устройство, которое позволяет преобразовать химическую энергию в электрическую. Основой работы гальванического элемента является электродная реакция, осуществляемая на поверхностях электродов. Ключевым элементом гальванического элемента является электрохимическая ячейка, состоящая из двух электродов – анода и катода, и электролита, служащего для передачи ионов между электродами.
Принцип работы гальванического элемента основан на разности электродных потенциалов между анодом и катодом. Анод – это электрод, на котором происходит окислительная реакция, при которой электроны отходят от атмосферы в электрод. Катод – это электрод, на котором происходит восстановительная реакция, катионы из электролита принимают электроны и переходят в молекулярное состояние.
Реакция на аноде происходит с выделением электронов, которые через внешнюю электрическую цепь перемещаются на катод. При этом электролит, находящийся между электродами, обеспечивает миграцию ионов в противоположном направлении. Это создает разность потенциалов между электродами и позволяет получить электрический ток.
Важным параметром гальванического элемента является электродный потенциал каждого электрода. Он определяется способностью материала электрода участвовать в реакции окисления или восстановления. Потенциал анода может быть положительным или отрицательным, в зависимости от того, какая реакция преобладает на поверхности электрода. Катод всегда имеет относительно более высокий потенциал, так как происходит восстановление вещества.
Гальванические элементы широко используются в различных устройствах и системах, таких как батарейки, аккумуляторы, источники питания и другие. Они обладают высокой энергоэффективностью и долгим сроком службы, что делает их незаменимыми во многих областях науки и промышленности.
Гальванический элемент и его роль в электрохимическом ряду
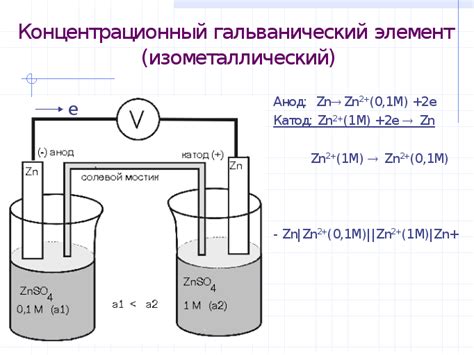
Гальванический элемент представляет собой устройство, в котором происходит превращение химической энергии в электрическую. Он состоит из двух электродов, обладающих разными электрохимическими потенциалами, и электролита, обеспечивающего ионную проводимость.
Работа гальванического элемента основана на разности электродных потенциалов между электродами. Когда электроды размещены в электролите, происходит перенос электронов от электрода с более высоким электродным потенциалом к электроду с более низким электродным потенциалом. Этот перенос электронов создает электрический ток, который может использоваться для приведения в действие электрических устройств.
Гальванический элемент играет важную роль в электрохимическом ряду. Этот ряд представляет собой упорядоченный список металлов по их электродным потенциалам. Металлы, имеющие более высокий электродный потенциал, называются положительными электродами, а металлы с более низким потенциалом - отрицательными. Поэтому при соединении двух разных металлов в гальваническом элементе, потенциал положительного металла становится выше, а отрицательного - ниже. Это приводит к возникновению электрического потенциала, который используется в различных электрических устройствах и батареях.
Расположение металлов в электрохимическом ряду также определяет их способность окисляться или восстанавливаться. Металлы, находящиеся ближе к началу ряда, имеют большую способность окисляться, то есть терять электроны. Металлы, находящиеся ближе к концу ряда, обладают большей способностью восстанавливаться, то есть приобретать электроны. Эта информация играет важную роль при проведении различных электрохимических процессов, таких как электролиз и коррозия металлов.
Электродные потенциалы металлов: важные аспекты в гальваническом элементе
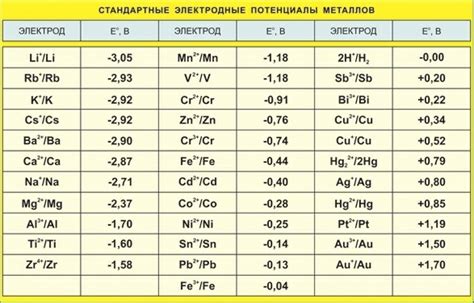
Электродные потенциалы металлов играют важную роль в гальваническом элементе. Электродный потенциал - это мера способности металла или электрода восстанавливать или окисляться в растворе. Каждый металл имеет свой уникальный электродный потенциал, который можно использовать для создания гальванической пары.
В гальваническом элементе металлы соединяются электролитом, образуя два полупространства: анод и катод. Электрод металла с более высоким знаком электродного потенциала становится анодом, а с меньшим знаком - катодом. При соединении анода и катода через внешнюю нагрузку происходит поток электронов от анода к катоду.
Электродные потенциалы металлов в гальваническом элементе определяют направление потока электронов и обеспечивают электрическую энергию. Чем больше разница в электродных потенциалах между анодом и катодом, тем большая энергия может быть получена от гальванического элемента. Поэтому выбор правильных металлов для создания гальванического элемента является важным аспектом его эффективности и долговечности.
Порядок электродных потенциалов металлов определен электрохимическим рядом напряжений. Этот ряд позволяет сравнивать электродные потенциалы различных металлов и определить их относительную "силу" в гальваническом элементе. К некоторым металлам можно добавить специальные реагенты или добавки, чтобы изменить их электродный потенциал и повысить эффективность гальванического элемента.
Вопрос-ответ

Есть ли разница между гальваническим элементом и электродным потенциалом?
Да, это два разных понятия в электрохимии. Гальванический элемент - это электрохимическая система, в которой происходят реакции окисления и восстановления, сопровождающиеся выделением электрической энергии. Электродный потенциал, с другой стороны, является количественной характеристикой способности электрода принимать электроны при окислении или отдавать их при восстановлении.
Какие металлы обладают самым высоким электродным потенциалом?
Металлы, обладающие самым высоким электродным потенциалом, так называемые "ноблевые металлы", включают платину, золото и родий. Они имеют tendancy отдавать электроны и быть окисленным в реакциях электродных потенциалов.
Какое значение электродного потенциала у металла, если он легирует другой металл?
В связи с тем, что легирование влияет на структуру и свойства металла, оно также может влиять на его электродный потенциал. В зависимости от типа и концентрации легирующего вещества электродный потенциал металла может как повыситься, так и понизиться.
Какие факторы влияют на электродный потенциал металлов?
Электродный потенциал металлов зависит от нескольких факторов, таких как концентрация ионов этого металла в растворе, рН среды, температура и тип солей, а также присутствие других веществ в растворе. Например, увеличение концентрации ионов металла обычно увеличивает его электродный потенциал.
