Гальванические пары металлов – это электрохимические системы, основанные на разности потенциалов между разными металлами. Принцип работы таких пар основан на том, что воздействие электролита на металлы вызывает процессы окисления и восстановления, что приводит к генерации электрического тока.
Одним из основных применений гальванических пар металлов является производство батареек и аккумуляторов. Благодаря принципу работы гальванических пар, эти устройства способны накапливать и отдавать энергию в виде электрического тока. Такие батарейки и аккумуляторы широко используются в различных сферах нашей жизни – от портативных электронных устройств до автомобильной промышленности.
Гальванические пары металлов также находят применение в электрохимическом производстве. Они используются для электроосаждения металлических покрытий на поверхности различных изделий. Это позволяет улучшить антикоррозионные и декоративные свойства изделий, а также повысить их стойкость к истиранию и износу.
Также гальванические пары металлов находят применение в аналитической химии. В частности, они используются для определения содержания металлов в растворах и образцах. Методы гальванических пар являются одним из наиболее точных и надежных способов анализа металлов и широко применяются в лабораториях и научных исследованиях.
Принцип работы гальванических пар металлов

Гальваническая пара металлов основана на принципе электрохимической реакции между двумя различными металлами, находящимися в электролите. При наличии разности электродных потенциалов между металлами образуется цепь, в которой происходит движение электронов от одного металла к другому через электролит.
В гальванической паре один металл выступает в роли анода, а другой – в роли катода. Анод – это вещество, с которого происходит окисление, либо потеря электронов. Катод – это вещество, которое принимает электроны или происходит его восстановление.
Процесс образования гальванической пары определяется разностью потенциалов между двумя металлами. Металл с более отрицательным потенциалом будет выступать в роли анода, а металл с более положительным потенциалом – в роли катода.
Работа гальванической пары основывается на преобразовании химической энергии в электрическую. При этом происходит окисление металла на аноде (образуется ион металла), а на катоде ионы металла принимают электроны и осаждается металлическое вещество.
Электрохимические реакции и переход электронов
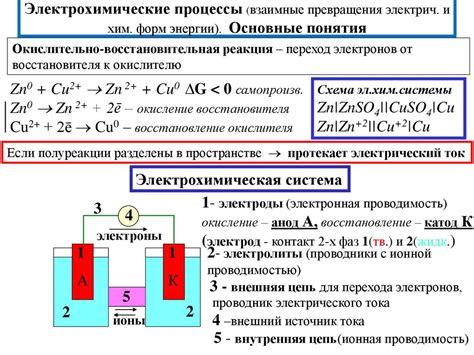
Гальваническая пара является основным примером электрохимической реакции, в которой происходит перенос электронов между металлами. Электрохимические реакции основаны на принципе, что разные металлы имеют различное электрохимическое потенциал.
В гальванической паре один металл, называемый анодом, имеет более высокий электрохимический потенциал и становится окисляющим агентом. Другой металл, называемый катодом, имеет более низкий электрохимический потенциал и становится восстанавливающим агентом.
При соединении двух металлов в гальванической паре с помощью электролита происходит перенос электронов от анода к катоду. Это происходит через внешнюю цепь, по которой проходит электрический ток.
- Анодные реакции: на аноде происходит окисление атомов металла, также известное как анодный оксид или анодное растворение.
- Катодные реакции: на катоде происходит восстановление ионоцентрированных металлов или осаждение металла из электролита.
Когда анод окисляется и теряет электроны, они перемещаются по внешней цепи к катоду, где они используются для восстановления ионоцентрированных ионов или осаждения металла на поверхности катода.
Гальванические пары металлов широко применяются в различных областях, таких как электрохимические источники энергии, гальваническая защита металлических конструкций от коррозии, электрокатализ и многие другие. Изучение и понимание электрохимических реакций и перехода электронов между металлами имеет важное практическое значение для разработки и усовершенствования различных устройств и технологий.
Основные свойства гальванических пар

Гальваническая пара - это система, состоящая из двух металлов, погруженных в электролит и соединенных проводом. Одно из свойств гальванических пар - возникновение разности потенциалов между двумя металлами. Эта разность потенциалов стимулирует перемещение электронов от металла с более высоким потенциалом к металлу с более низким потенциалом, что создает электрический ток.
Еще одно свойство гальванических пар - их коррозионная активность. Некоторые металлы обладают большей склонностью к окислению и реагируют с электролитом, образуя ионные соединения и выделяя электроны. Такие металлы являются активными и выступают в роли анода в гальванической паре.
Другие металлы меньше подвержены окислению и имеют большую тенденцию к присоединению электронов. Эти металлы выступают в роли катода и обеспечивают протекание обратной реакции - восстановление ионов металла к исходному состоянию. Такое устройство гальванической пары позволяет предотвратить коррозию катодного металла.
Гальванические пары применяются во многих областях, включая производство электрической энергии, аккумуляторы, электрохимическое сужение и расширение металлов, а также защиту от коррозии. Пары могут быть сформированы из различных сочетаний металлов, что делает их универсальным и эффективным инструментом в различных приложениях.
Интересно отметить, что свойства гальванических пар не зависят только от металлов, но и от условий окружающей среды, таких как температура, pH электролита и наличие примесей. Поэтому для достижения оптимальной работы гальванической пары необходимо учитывать все эти факторы и правильно подобрать компоненты системы.
Разность потенциалов и способность к окислительным и восстановительным процессам

Гальваническая пара металлов представляет собой систему, в которой два различных металла контактируют друг с другом через электролит. В такой системе происходят окислительные и восстановительные процессы, связанные с передачей электронов от одного металла к другому.
Разность потенциалов между двумя металлами в гальванической паре является основным фактором, определяющим способность пары к генерации электрического тока. Когда два металла имеют разную аффинность к электронам, возникает электрический потенциал, который может стать источником электрической энергии.
Металл с более высоким электроотрицательным потенциалом считается окислителем, поскольку он имеет большую способность принимать электроны от другого металла в процессе окисления. Металл с более низким электроотрицательным потенциалом считается восстановителем, поскольку он имеет большую способность отдавать электроны в процессе восстановления.
Использование гальванических пар металлов позволяет решать различные задачи. Например, в аккумуляторах гальваническая пара металлов используется для хранения и высвобождения электрической энергии. Также гальванические пары используются в процессе электрохимического покрытия металла, где происходит передача электронов от одного металла к другому для формирования защитного покрытия на поверхности металла.
Возможности использования гальванических пар металлов
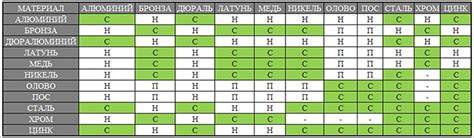
Гальванические пары металлов широко используются в различных промышленных процессах и бытовых приложениях. Они могут быть полезными в таких областях, как электрохимия, электрокаталитические реакции, коррозионная защита и даже медицина.
Одним из наиболее распространенных применений гальванических пар металлов является их использование в батарейках. Батарейки на основе гальванических пар металлов, таких как цинк и медь, обеспечивают надежное и экономичное источник питания для множества электронных устройств.
Гальванические пары металлов также используются в процессе гальваностегии. Эта технология применяется в промышленности для покрытия металлических изделий тонким слоем другого металла, чтобы улучшить их внешний вид, защитить от коррозии или изменить их химические свойства. Например, пара меди и никеля может быть использована для создания прочного и блестящего покрытия на металлических предметах.
Еще одним интересным применением гальванических пар металлов является использование их в электрохимических сенсорах. Эти сенсоры могут измерять концентрацию различных веществ в растворах, используя изменение электрического тока, проходящего через гальваническую пару металлов. Такие сенсоры находят применение как в медицинских исследованиях, так и в окружающей среде контроле.
Кроме промышленного использования, гальванические пары металлов могут быть применены в бытовых целях. Например, пара алюминия и железа может использоваться для очищения воды от загрязнений и бактерий. При этом происходит окисление алюминия, что приводит к уничтожению патогенных организмов в воде.
В целом, гальванические пары металлов представляют собой мощный инструмент с широкими возможностями применения. Они нашли свое применение в различных отраслях науки и техники, от энергетики до медицины, и продолжают развиваться, предоставляя новые способы использования металлов для решения различных задач.
Применение в электротехнике и промышленности

Гальванические пары металлов находят широкое применение в электротехнике и промышленности благодаря своим химическим и электрическим свойствам.
Одним из основных применений гальванических пар является создание электрической энергии в батарейках. Благодаря разности потенциалов между различными металлами, возникает электрический ток, который может быть использован для питания различных электронных устройств.
В промышленности гальванические пары металлов используются для проведения электролиза. При этом происходит разложение растворенных веществ на электроды, что позволяет получать металлы высокой чистоты. С помощью этого процесса производятся различные металлические изделия, включая провода, покрытия и другие продукты.
Гальванические пары металлов также используются для защиты металлических конструкций от коррозии. Путем создания гальванической связи между металлами, коррозионные процессы смещаются на электрод с более высоким потенциалом, что препятствует повреждениям металлической поверхности.
Кроме того, гальванические пары металлов находят применение в процессах пайки и сварки. С их помощью можно создавать прочные и надежные соединения металлических деталей различных материалов.
Вопрос-ответ

Как работает гальваническая пара?
Гальваническая пара состоит из двух различных металлических электродов, погруженных в электролит. При этом каждый электрод имеет свой потенциал. Первый электрод, более активный (анод), распадается на ионы, которые переносятся через электролит к второму электроду, менее активному (катод), и ионизируются на его поверхности. Это приводит к тому, что первый электрод окисляется, а второй — восстанавливается. Таким образом, в гальванической паре происходит преобразование химической энергии в электрическую.
Какие металлы являются самыми активными в гальванических парах?
Самыми активными металлами в гальванических парах являются аллюминий, цинк, железо, магний. Они обладают большей способностью окисляться и выступают в роли анодов. Более пассивные металлы, такие как медь, серебро, золото, обычно являются катодами.
Какие процессы могут происходить в гальванической паре?
В гальванической паре могут происходить различные процессы, в зависимости от потребностей и условий. Если эксплуатируется металл, способный к растворению, то анод окисляется, а катод восстанавливается. В случае, когда металлом покрыт предмет, происходит обратная реакция: анод восстанавливается, а катод окисляется. Также могут происходить процессы нанесения металлического покрытия на объект, электролиза и другие.
Какие возможности использования у гальванических пар металлов?
Гальванические пары металлов широко применяются в различных областях. Одно из главных направлений использования — в производстве и ремонте электроники. Гальваническое осаждение металлов позволяет создавать электрические контакты, пайку плат, нанесение покрытий для защиты от коррозии. Они также используются в производстве батарей, аккумуляторов, гальванических элементов, в водоочистке, в гальваническом покрытии различных материалов и многое другое.
