Галогены - это химическая группа элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они часто ассоциируются с металлами из-за своей высокой электроотрицательности и способности образовывать ионы. Однако галогены на самом деле не являются металлами, а представляют собой неметаллы.
Принципиальная разница между галогенами и металлами заключается в их электронной структуре. Галогены имеют внешний электронный уровень заполненный до максимума, что делает их более стабильными и несклонными к образованию ионов. В то время как металлы, напротив, имеют неполный внешний электронный уровень и легко образуют ионы положительного заряда. Эта разница в электронной структуре объясняет различные химические свойства галогенов и металлов.
Галогены обладают высокой реактивностью и образуют с металлами соли, но сами они не обладают металлическими свойствами. Они обладают хорошими окислительными свойствами и способны взаимодействовать с многими другими химическими элементами.
Галогены широко используются в различных отраслях науки и промышленности. Например, фтор широко применяется в производстве различных химических соединений, включая полимеры, хладагенты и фармацевтические препараты. Хлор используется для очистки воды, в производстве пластиков и химических реакций. Бром используется в фотографии и в производстве огнезащитных материалов. А йод является важным питательным элементом и используется в медицине.
Таким образом, галогены - это неметаллы, несмотря на некоторое сходство с металлами в своих химических свойствах. Их уникальные физические и химические свойства делают их важными для многих отраслей науки и промышленности.
Понятие галогенов

Галогены – группа химических элементов, которая включает в себя фтор, хлор, бром, иод и астат. Они относятся к группе 17 (VIIA) периодической системы Менделеева и обладают сходными химическими свойствами. В свободном состоянии галогены представлены двухатомными молекулами, например, F2, Cl2, Br2.
Главной особенностью галогенов является высокая реакционность, вызванная наличием семеречной оболочки электронов во внешнем энергетическом уровне. Они стремятся энергетически выгодно завершить расположение электронов в этом уровне. Для этого галогены образуют с соединениями межмолекулярные и внутримолекулярные связи.
Галогены являются одними из лучших окислителей. Они способны активно взаимодействовать с другими веществами, образуя с ними химические соединения. Также галогены обладают ярко выраженными токсичными и агрессивными свойствами, поэтому требуют осторожного обращения.
Галогены широко используются в различных отраслях науки и промышленности. Например, фтор применяется в процессах производства полупроводников, аккумуляторов и пластмасс. Хлор используется при производстве пищевых добавок и обеззараживании воды. Бром используется в производстве огнезащитных материалов и фармацевтической промышленности. Иод используется в лекарствах и для обеззараживания. Астат является редким и радиоактивным элементом, применение которого ограничено.
Галогены: классификация и свойства
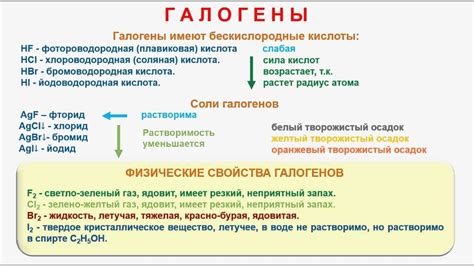
Галогены - это элементы группы 17 (группа VIIA) периодической таблицы элементов. К этой группе относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Галогены являются неметаллами и обладают рядом уникальных свойств.
Фтор - наиболее реакционный элемент из группы галогенов. Он образует наиболее сильные связи с другими элементами и обладает самым высоким электроотрицательностью. Фтор часто используется в производстве химических соединений и в качестве агента для очистки и дезинфекции.
Хлор - второй по реакционности элемент из группы галогенов. Хлор широко применяется в качестве дезинфицирующего средства для очистки воды и бассейнов. Он также используется в производстве множества химических соединений и материалов, включая пластик и хлорированные органические соединения.
Бром - жидкий элемент из группы галогенов. Он обладает высокими свойствами окисления и может использоваться в качестве реагента для многих органических реакций. Бром также применяется в качестве огнезащитного средства для пластика и тканей.
Йод - твердый элемент из группы галогенов. Он широко используется в медицине в качестве антисептика для обработки ран и ранок. Йод также является необходимым элементом для нормальной работы щитовидной железы.
Астат - наиболее редкий и радиоактивный элемент в группе галогенов. Его свойства и применения изучаются в рамках научных исследований. Астат также содержит самые тяжелые изотопы всех элементов в группе галогенов.
В целом, галогены обладают высокой реакционностью и являются сильными окислителями. Они также образуют соли с металлами, которые часто используются в промышленности и в химических процессах. Галогены имеют важное значение в различных областях, включая медицину, потребительские товары и электронику.
Химическое строение галогенов
Галогены – это химическая группа элементов, которая включает в себя фтор, хлор, бром, йод и астат. Они обладают уникальным химическим строением, которое отличается от других элементов периодической таблицы.
Галогены имеют семь электронов в своей внешней электронной оболочке. Это делает их очень реактивными и склонными к образованию химических соединений с другими элементами. Галогены стремятся к полному заполнению своей внешней оболочки, а для этого им не хватает одного электрона.
Химическое строение галогенов также определяет их физические свойства. Они обладают низкой температурой плавления и кипения, что делает их газами или жидкостями при комнатной температуре. Кроме того, они обладают высокой растворимостью в воде и имеют хорошую проводимость электричества и тепла.
Галогены могут формировать соли и кислоты. Они являются существенными элементами для многих биологических процессов и важными компонентами во многих промышленных продуктах. Фтор, хлор и бром используются в производстве пластмасс, солнечных батарей, тканей, медикаментов и многих других материалов и продуктов. йод используется в медицине, а астат – в научных исследованиях.
Химическое строение галогенов делает их очень важными элементами в нашей жизни и промышленности. Их уникальные свойства и способность образовывать разнообразные соединения позволяют использовать их в различных областях науки и промышленности.
Полезность и применение галогенов в различных отраслях
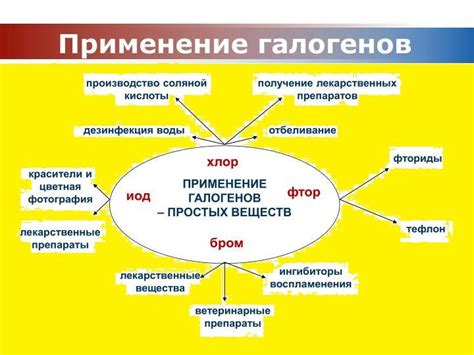
Галогены - это химические элементы, отличающиеся высокой активностью и электроотрицательностью. Они включают в себя фтор, хлор, бром, йод и астат. Многие из этих галогенов находят широкое применение в различных отраслях нашей жизни.
Первым и самым распространенным галогеном является фтор. Он широко используется в производстве алюминия, стекла, пластиков, цемента и многих других материалов. Фтор также является важным компонентом в производстве многих химических соединений и лекарств.
Хлор также является важным галогеном, который находит применение в различных отраслях. Он используется в производстве пластиков, воды для плавательных бассейнов, белизны для текстиля, дезинфицирующих средствах и многих других продуктах.
Бром используется во многих областях, включая производство пламя-защитной ткани, маркировки, судового сжигания отходов и различных химических соединений. Он также находит применение в фотографии, медицине и синтезе органических соединений.
Йод широко используется в медицине, в производстве реагентов для анализа, а также в косметической и парфюмерной промышленности. Он является важным элементом для нормального функционирования щитовидной железы.
Астат – самый редкий и наименее изученный галоген. Он может быть использован в ядерных исследованиях, а также в некоторых процессах синтеза элементов.
В целом, галогены находят широкое применение в разных отраслях: от промышленности до науки и медицины. Их уникальные свойства делают их ценными веществами, которые нашли применение во многих сферах человеческой деятельности.
Галогены и металлы: параллели и различия
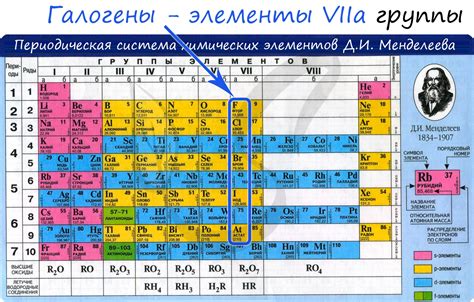
Галогены:
- Вещества, относящиеся к группе галогенов, включают фтор (F), хлор (Cl), бром (Br) и йод (I).
- Галогены являются неметаллами и обладают высокой электроотрицательностью, что связано с их способностью принимать электроны от других элементов.
- Они образуют одну из групп периодической системы элементов и расположены справа от щелочных металлов и щелочноземельных металлов.
- Галогены обладают высокой реактивностью и образуют стабильные соли со щелочными и щелочноземельными металлами, а также со многими другими элементами.
- Они имеют высокую плотность и температуру плавления, а их физические свойства варьируют в зависимости от каждого галогена.
Металлы:
- Металлы представлены в периодической системе элементов слева от линии, их разделяющей на металлы и неметаллы. Часто к ним относят щелочные и щелочноземельные металлы, а также переходные металлы.
- Они обладают такими характеристиками, как блеск, хорошая проводимость тепла и электричества, гибкость и пластичность.
- Металлы имеют способность образовывать положительные ионы, отдавая электроны.
- Время полураспада у металлов может быть очень разным, некоторые из них имеют очень долгий срок полураспада.
- Они обладают большой прочностью и являются основными строительными блоками многих материалов, включая сталь, алюминий и медь.
Параллели и различия:
| Характеристика | Галогены | Металлы |
|---|---|---|
| Расположение в периодической системе элементов | Справа от щелочных металлов и щелочноземельных металлов | Слева от линии, разделяющей металлы и неметаллы |
| Электроотрицательность | Высокая | - |
| Химическая реактивность | Высокая | - |
| Способность образовывать положительные ионы | - | Все металлы |
| Физические свойства | Высокая плотность и температура плавления | Блеск, проводимость тепла и электричества, гибкость и пластичность |
Таким образом, галогены и металлы имеют как параллели, так и различия, связанные с их положением в периодической системе элементов, электроотрицательностью, химической реактивностью, способностью образовывать положительные ионы и физическими свойствами.
Вопрос-ответ

Что такое галогены?
Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они находятся в 17-й группе периодической системы элементов и обладают характерными свойствами.
Являются ли галогены металлами?
Нет, галогены не являются металлами. Они являются неметаллическими элементами и обладают несколькими характерными свойствами, отличающимися от свойств металлов.
Какие свойства галогенов отличают их от металлов?
Галогены обладают рядом характерных свойств, которые отличают их от металлов. Например, они имеют высокую электроотрицательность, образуют отрицательно заряженные ионы, обладают высокой реактивностью и способностью образовывать соль. Также они имеют низкую температуру плавления и кипения, в отличие от металлов, которые имеют обычно высокие температуры плавления и кипения.
Есть ли у галогенов какие-либо металлические свойства?
Хотя галогены в целом не обладают металлическими свойствами, некоторые из них могут проявлять металлическое поведение при определенных условиях. Например, плавящийся бром может проводить электрический ток и имеет металлическую блеск.
Влияют ли галогены на окружающую среду?
Да, галогены могут оказывать влияние на окружающую среду. Например, они способны образовывать различные токсичные соединения. Кроме того, некоторые галогены, такие как хлор и фтор, используются в промышленности и могут негативно влиять на окружающую среду при неправильном использовании или выбросе.
