Галогены щелочных металлов - это группа элементов, которые состоят из трех главных химических элементов: фтора, хлора и брома. Они относятся к категории химических элементов, которые находятся на крайнем правом столбце периодической таблицы элементов. Галогены щелочных металлов имеют ряд уникальных свойств, которые делают их особо интересными для научных и промышленных исследований.
Одним из наиболее примечательных свойств галогенных щелочных металлов является их высокая реактивность. Фтор, хлор и бром являются сильными окислителями, что означает, что они могут с легкостью отдавать электроны другим веществам. Это обуславливает возможность использования галогенов для различных применений, включая дезинфекцию, очистку воды и в процессах синтеза органических соединений.
Галогены щелочных металлов также обладают высокой электроотрицательностью, что делает их очень гидрофильными. Это означает, что они могут легко растворяться в воде и образовывать различные химические соединения с веществами, которые встречаются в природе. Эта особенность галогенов позволяет использовать их в медицине, фармацевтике, производстве полимеров и других отраслях промышленности.
Выводящие из этого заключение, галогены щелочных металлов являются важной частью химии и промышленности, благодаря своим уникальным свойствам и широкому спектру применения. Изучение этих элементов продолжается и может привести к новым открытиям и применениям в ближайшем будущем.
Свойства галогенов щелочных металлов
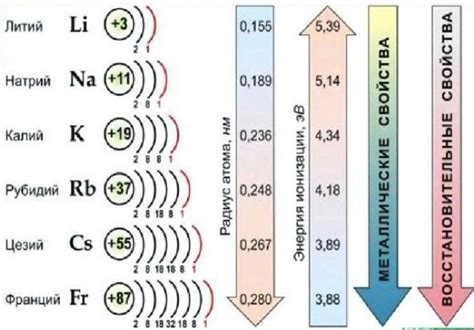
Галогены - это элементы, входящие в седьмую группу периодической таблицы. К галогенам относятся хлор (Cl), бром (Br), йод (I), а также астат (At) и теннессин (Ts), которые являются радиоактивными и очень редкими.
Галогены щелочных металлов, в свою очередь, являются связанными с элементами седьмой группы периодической таблицы и щелочными металлами, такими как литий (Li), натрий (Na), калий (K) и другие.
Основные свойства галогенов щелочных металлов:
- Электроотрицательность: Галогены щелочных металлов обладают высокой электроотрицательностью, что делает их хорошими окислителями.
- Восстановительные свойства: Галогены щелочных металлов могут выступать в качестве восстановителей при реакциях с другими веществами.
- Высокая агрессивность: Галогены щелочных металлов характеризуются высокой реакционной способностью и агрессивностью, особенно взаимодействуя с другими элементами.
- Образование ионов: Галогены щелочных металлов образуют отрицательно заряженные анионы, например, ионы хлорида, бромида и йодида.
- Образование солей: Галогены щелочных металлов вступают в реакции с щелочными металлами, образуя соли, например, натрий хлорида (NaCl) и калий бромида (KBr).
Свойства галогенов щелочных металлов определяют их широкое применение в различных областях науки и промышленности, например, в производстве химических соединений, фармацевтике, стекловарении и многих других.
Физические свойства галогенов щелочных металлов

Галогены щелочных металлов - это элементы, включающие фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). У каждого из этих галогенов есть уникальные физические свойства, которые отличают их от других веществ.
Одним из основных физических свойств галогенов щелочных металлов является их высокая электроотрицательность, что делает их сильными окислителями. Также они обладают жидким или газообразным состоянием при комнатной температуре, за исключением иода, который является твердым веществом.
Другим важным физическим свойством галогенов щелочных металлов является их высокая летучесть. Галогены могут быстро испаряться и образовывать пары, что делает их полезными в различных промышленных процессах и химических реакциях.
Также следует отметить, что галогены щелочных металлов образуют сольные соединения с другими элементами, такими как металлы или неметаллы. Эти соединения обычно обладают высокой химической стабильностью и часто используются в промышленности, медицине и научных исследованиях.
И, наконец, галогены щелочных металлов обладают следующими физическими свойствами: они обладают яркой окраской, образуют галогениды щелочных металлов, помогают регулировать химические реакции, улучшают проводимость электричества и обладают хорошими свойствами фоточувствительности.
Химические свойства галогенов щелочных металлов

Галогены щелочных металлов – это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br) и йод (I). Каждый из этих элементов обладает своими уникальными химическими свойствами, которые делают их полезными в различных областях науки и промышленности.
Первое химическое свойство галогенов щелочных металлов – высокая электроотрицательность. Это значит, что они имеют сильную способность притягивать электроны. Благодаря этому свойству галогены могут образовывать стабильные отрицательно заряженные ионы.
Второе химическое свойство галогенов – высокая активность. Они легко вступают в химические реакции, особенно с металлами. Галогены могут образовывать с ними соединения, такие как хлориды, бромиды и йодиды щелочных металлов.
Третье химическое свойство галогенов – разнообразие окружающих состояний. Они могут быть в газообразной, жидкой или твердой форме в зависимости от условий температуры и давления. Например, фтор и хлор обычно находятся в газообразном состоянии, а бром и йод могут быть жидкими или твердыми веществами.
Галогены щелочных металлов широко используются в различных отраслях, включая химическую промышленность, фармацевтику, электронику и производство осветительных приборов. Например, хлор используется для производства пластмасс и пестицидов, а фтор применяется в производстве тефлоновых покрытий и огнезащитных материалов.
Использование галогенов щелочных металлов:

1. В производстве и промышленности: Галогены щелочных металлов находят широкое применение в различных отраслях производства и промышленности. Например, хлор используется для получения пищевых добавок, дезинфекции воды, производства пластиков, соединений полимеров и многих других материалов. Фтор применяется в производстве многочисленных химических соединений, в процессе производства стекла и электроники.
2. В медицине: Использование галогенов щелочных металлов в медицинской сфере также является значительным. Например, хлор используется для дезинфекции инструментов и помещений в больницах, производства лекарственных средств. Иод применяется в препаратах для лечения щитовидной железы и для рентгенографии. Фтор применяется в зубных пастах и препаратах для кариесопрофилактики.
3. В энергетике и электронике: Галогены щелочных металлов используются в энергетическом секторе для производства батарей и аккумуляторов. Например, йодид кадмия используется в солнечных панелях. Также, галогены используются в электронике для производства полупроводников и диодов.
4. В экологии и охране окружающей среды: Галогены щелочных металлов играют важную роль в очистке воды, воздуха и почвы. Например, хлор используется для дезинфекции воды и очистки от канцерогенных веществ. Фтор используется для очистки отрастаящей воды от бактерий и вирусов. Иод применяется для дезинфекции поверхностей в больницах и лечебных учереждениях.
5. В сельском хозяйстве: Галогены щелочных металлов используются в сельском хозяйстве для защиты растений от вредителей. Например, хлор используется для дезинфекции почвы и уничтожения сорняков. Фтор применяется для опрыскивания растений и защиты от вредных насекомых.
Применение галогенов щелочных металлов в промышленности

Галогены щелочных металлов - это элементы химической группы VII (17) периодической системы, а именно: фтор (F), хлор (Cl), бром (Br) и йод (I). Эти элементы находят широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам и возможностям.
Фтор, химический элемент с самым высоким электроотрицательностью, используется в производстве полупроводников, стальной и алюминиевой индустрии. Он является необходимым компонентом для получения огнестойких и прочных пластмасс, а также используется для создания прозрачного фторированного водорода для ракетных исследовательских целей.
Хлор, один из наиболее широко используемых галогенов в промышленности, применяется в процессах производства пластмасс, текстиля, бумаги, медицинских препаратов и многого другого. Хлор используется для очистки воды, обработки отпадков и дезинфекции поверхностей, а также является важным компонентом в производстве хлорной извести и пластиковых изделий.
Бром также находит применение в различных отраслях промышленности. Он используется в производстве огнезащитных материалов, фотопленок, дезинфекции воды и бассейнов. Бром является важным компонентом в производстве лекарственных препаратов, пестицидов и красителей.
Йод, меньше всего используется в промышленности даже по сравнению с другими галогенами. Он применяется в производстве зубных паст, фотопленок, санитарных препаратов и средств для обработки кожи. За счет своих антисептических свойств, йод находит применение как в медицине, так и в процессах очистки воды.
Применение галогенов щелочных металлов в медицине

Галогены щелочных металлов, такие как фтор, хлор, бром и йод, играют важную роль в медицине благодаря своим химическим свойствам и биологической активности. Они широко используются в различных медицинских процедурах и формулах для лечения различных заболеваний.
Фтор, являющийся наиболее высокоактивным элементом из галогенов щелочных металлов, применяется в стоматологии для профилактики кариеса. Фториды используются для пропитывания зубов, что повышает их стойкость к разрушению и предотвращает образование зубного налета.
Хлор широко применяется в качестве дезинфицирующего средства при очистке воды. Хлор реагирует с бактериями и вирусами, уничтожая их и предотвращая распространение инфекций. Также хлор используется при проведении медицинских анализов и тестов для дезинфекции инструментария.
Бром является частью веществ, применяемых для лечения различных кожных заболеваний, таких как экзема и псориаз. Бром и его соединения обладают противовоспалительными свойствами и способны снизить зуд и раздражение на коже.
Йод является неотъемлемой составной частью антисептических и дезинфицирующих средств. Йод используется для обработки ран, порезов и ожогов, так как он способен уничтожать патогенные микроорганизмы и предотвращать возникновение инфекции.
Таким образом, галогены щелочных металлов играют важную роль в медицине благодаря своим антисептическим, дезинфицирующим и противовоспалительным свойствам. Их использование в медицинских процедурах и лекарственных препаратах способствует эффективному лечению различных заболеваний и поддержанию общего здоровья человека.
Безопасность при использовании галогенов щелочных металлов
Галогены щелочных металлов, такие как фтор, хлор, бром и йод, обладают рядом важных свойств, но могут также представлять опасность при неправильном использовании. При работе с этими веществами необходимо соблюдать меры безопасности, чтобы избежать возможных негативных последствий.
Одно из основных свойств галогенов щелочных металлов - их высокая реакционность. Это означает, что они могут легко взаимодействовать с другими веществами, в том числе с органическими материалами. При работе с галогенами необходимо быть осторожным, чтобы избежать несчастных случаев и химических реакций, которые могут привести к образованию токсичных или взрывоопасных веществ.
При соприкосновении с галогенами щелочных металлов необходимо использовать защитное снаряжение. Это включает в себя защитные очки, перчатки, халат и другие предметы, которые могут предотвратить попадание галогенов на кожу или в глаза. Кроме того, рекомендуется работать в хорошо проветриваемой области или надевать респиратор, чтобы избежать вдыхания выделяющихся при работе с галогенами летучих веществ.
Галогены щелочных металлов должны храниться в специальных условиях. Они часто хранятся в герметичных контейнерах или бутылях с пробками, чтобы предотвратить контакт с воздухом. Это важно, потому что неконтролируемое взаимодействие между галогенами и воздухом может привести к возникновению опасных веществ. Кроме того, хранение галогенов щелочных металлов требует контроля температуры и влажности, чтобы избежать их разрушения или деградации.
В целом, работа с галогенами щелочных металлов требует строгого соблюдения мер безопасности. Правильное использование защитного снаряжения, хранение в соответствующих условиях и соблюдение предосторожностей помогут избежать возможной опасности и обеспечить безопасность при работе с этими веществами.
Вопрос-ответ

Какие свойства имеют галогены щелочных металлов?
Галогены щелочных металлов - это элементы группы 17 периодической таблицы, включающие фтор, хлор, бром, йод и астат. Они обладают высокой электроотрицательностью и являются сильными окислителями. Галогены щелочных металлов также имеют низкую температуру кипения и плотность, образуют ионные соединения с щелочными металлами, образуют кислоты, а также реагируют с многими органическими соединениями.
Какие области применения у галогенов щелочных металлов?
Галогены щелочных металлов имеют широкий спектр применения. Они используются в производстве химических продуктов, в качестве осветительных материалов, в производстве пластиков, в процессах очистки воды, для дезинфекции и стерилизации, для синтеза фармацевтических препаратов, в производстве дезодорантов и парфюмерных средств, а также в различных научных исследованиях.
Как галогены влияют на здоровье человека?
Галогены щелочных металлов могут быть токсичными и опасными для здоровья человека при прямом контакте или вдыхании их паров. Например, хлор может вызывать раздражение глаз и дыхательных путей, а бром может иметь отрицательное влияние на нервную систему. Фтор может быть опасным для зубов и костей, поэтому его содержание в питьевой воде должно быть ограничено. Важно соблюдать меры предосторожности при работе с галогенами щелочных металлов и следовать инструкциям по безопасности.
