Взаимодействие галогенов с металлами имеет особое значение в химии и материаловедении. Галогены – это элементы 17 группы периодической системы, включающие фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Эти элементы проявляют большой химический активность и способны образовывать стабильные соединения, включая с металлами.
Одной из основных особенностей взаимодействия галогенов с металлами является их способность к образованию ионных соединений. Галогены обладают высокой электроотрицательностью и, следовательно, сильной аффинностью к электронам. При контакте с металлами они могут отрицательно заряжаться и образовывать ионы галогенидов. Данное взаимодействие обусловлено возможностью галогенов проникающе влиять на электронную структуру металлов.
Кроме того, стоит отметить, что взаимодействие галогенов с металлами может протекать при повышенной температуре и давлении. В таких условиях происходят более интенсивные химические реакции, что позволяет получить более сложные соединения. Некоторые галогены также могут образовывать комплексные соединения с металлами, что существенно расширяет спектр возможных реакций.
Итак, взаимодействие галогенов с металлами открывает широкие возможности для создания новых материалов и соединений, а также исследования химических свойств элементов и их сочетаний. Данная область химии является активно исследуемой и обладает большим практическим значением для различных отраслей промышленности.
Химические свойства галогенов

Галогены – это химические элементы, включающие фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). Они являются самыми активными неметаллами в группе периодической системы. Галогены обладают характерными свойствами, которые определяют их взаимодействие с металлами.
Первое импонирующее свойство галогенов – их высокая электроотрицательность. Это означает, что они стремятся к получению электронов для заполнения своей внешней электронной оболочки. Именно поэтому галогены могут вступать в химические реакции с металлами, передавая электроны от металла к себе.
Второе характерное свойство галогенов – их сильная окислительная активность. Они способны окислять металлы, превращая их в соответствующие галогениды. При этом галогены сами восстанавливаются, приобретая незаряженные атомы.
Галогены образуют
- соединения с металлами
- сольные оксиды
- межсоставные галогениды
Таким образом, галогены являются активными химическими элементами, способными вступать в реакции с металлами и проявлять свои окислительные свойства. Изучение их взаимодействия с металлами является важным аспектом в области химии и материаловедения.
Взаимодействие галогенов с металлами: общая информация

Галогены — это элементы группы 17 (группа VIIА) периодической таблицы, включающие фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они обладают высокой электроотрицательностью и сильным окислительным потенциалом. Взаимодействие галогенов с металлами основано на образовании ионов галогенида и обменного взаимодействия с металлическими ионами.
При взаимодействии галогенов с металлами, образуется ионный кристалл, состоящий из положительно заряженных ионов металла и отрицательно заряженных ионов галогенида. Это обусловлено тем, что галогены, благодаря высокой электроотрицательности, способны отдавать электроны металлам, которые образуют положительные ионы.
Галогенная атомная ковалентная радиусы увеличиваются, двигаясь от фтора к астату, что взаимодействие и особенности связи галогенидов с металлами меняются. Так, фтор взаимодействует со многими металлами, включая самые активные, астат взаимодействует только с самыми реакционными металлами.
Взаимодействие галогенов с металлами широко используется в различных областях, включая синтез органических и неорганических соединений, производство лекарственных препаратов, катализ и др. Образованные галогениды металлов также имеют широкое применение, например, в качестве солей, промежуточных продуктов в химических реакциях и т.д.
Взаимодействие галогенов с металлами: электрохимические реакции
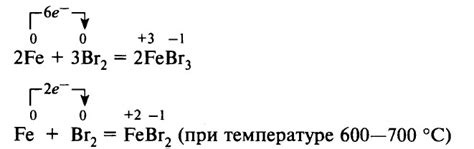
Взаимодействие галогенов с металлами является характерным электрохимическим процессом. Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), обладают высокой электроотрицательностью и стремятся к получению электронов. Металлы, в свою очередь, имеют низкую электроотрицательность и склонность к отдаче электронов.
Взаимодействие галогенов с металлами может протекать по двум основным электрохимическим реакциям: окислительно-восстановительным и обменным. В окислительно-восстановительном взаимодействии галоген принимает электрон от металла, превращаясь в анион, тогда как металл окисляется, отдавая электроны.
Обменное взаимодействие галогенов с металлами происходит на основе образования ионных соединений. Металл отдает свои электроны, становясь катионом, который образует ионное соединение с анионом галогена. Эта реакция обычно протекает при высоких температурах или в присутствии катализаторов.
Взаимодействие галогенов с металлами: образование солей

Галогены - это химические элементы группы 17 периодической системы, включающие фтор (F), хлор (Cl), бром (Br) и йод (I). Взаимодействие галогенов с металлами является одной из важных реакций, которые приводят к образованию солей.
При взаимодействии галогенов с металлами образуются ионные соединения, называемые солями. Они имеют характерные кристаллические решетки и отличаются от металлов и галогенов своими физическими и химическими свойствами.
В общем случае, взаимодействие галогенов с металлами протекает по следующему схематическому уравнению:
- M + X2 → MX2
Здесь M обозначает металл, а X - галоген. Результатом такой реакции является образование соли, состоящей из катиона металла M и аниона галогена X.
Например, при реакции натрия (Na) с хлором (Cl) образуется хлорид натрия (NaCl), который является наиболее распространенной солью в природе.
Взаимодействие галогенов с металлами является необходимым для синтеза различных соединений и материалов, таких как соли, кислоты, сплавы и полимеры. Они также используются в различных отраслях промышленности, включая производство удобрений, пищевых добавок, лекарственных препаратов и многого другого.
Взаимодействие галогенов с металлами: образование комплексных соединений

Взаимодействие галогенов с металлами является одним из важных процессов в химии. Галогены, такие как фтор, хлор, бром и йод, имеют высокую активность и способность образовывать стабильные комплексные соединения с металлами.
При взаимодействии галогена с металлом происходит образование комплексного соединения, которое обладает определенными свойствами и структурой. Галоген обычно действует в качестве лиганда, то есть он образует координационную связь со свободными электронными парами металла. В результате этого образуется комплексное соединение, в котором металл и галоген связаны между собой.
Образование комплексных соединений галогенов с металлами имеет множество практических применений. Например, такие соединения используются в качестве катализаторов в различных химических реакциях, а также в процессе синтеза органических и неорганических соединений. Они также находят применение в фармацевтической и медицинской промышленности, а также в производстве материалов и полимеров.
Взаимодействие галогенов с металлами: каталитическая активность

Взаимодействие галогенов с металлами является важной областью химических исследований. Одной из интересных особенностей этого взаимодействия является каталитическая активность галогенов при различных химических реакциях.
Каталитическая активность галогенов особенно хорошо проявляется при проведении реакций окисления органических соединений. Например, хлор может служить катализатором при окислении алканов, а фтор – при окислении некоторых органических соединений сильными окислителями. Каталитическое действие галогенов обусловлено их электрофильными свойствами и способностью образовывать комплексы с реагирующими веществами.
Кроме того, взаимодействие галогенов с металлами может приводить к образованию каталитически активных гетерогенных систем. Например, проведение реакций галогенации в присутствии металлических катализаторов позволяет увеличить скорость процесса и улучшить его селективность. Галогенаты металлов также могут обладать катализаторской активностью при различных химических реакциях.
Таким образом, взаимодействие галогенов с металлами проявляет каталитическую активность и имеет широкое применение в различных химических процессах. Дальнейшие исследования в этой области могут привести к появлению новых эффективных катализаторов и развитию новых методов синтеза органических соединений.
Взаимодействие галогенов с металлами: применение в промышленности

Взаимодействие галогенов с металлами находит широкое применение в различных отраслях промышленности. Одним из основных способов использования данного процесса является получение солей металлов.
Соли металлов, полученные в результате взаимодействия галогена с металлом, используются в химической промышленности для получения различных продуктов. Например, фторид натрия (NaF) применяется в стекольной промышленности для улучшения оптических свойств стекла, а хлорид железа (FeCl2) используется в процессе улавливания вредных газов в железорудной промышленности.
Другим способом применения взаимодействия галогенов с металлами является использование данного процесса для получения катализаторов. Например, бромид платины (PtBr2) используется в процессе гидрогенирования органических соединений, а фторид никеля (NiF2) применяется в качестве катализатора в полимерной индустрии.
Также взаимодействие галогенов с металлами находит применение в электротехнической промышленности. Например, хлорид меди (CuCl2) используется для гальванического покрытия поверхностей металла, что повышает их коррозионную стойкость и долговечность.
В целом, взаимодействие галогенов с металлами является важным процессом, который находит широкое применение в промышленности. Основной преимуществом данного способа является возможность получения солей металлов и катализаторов, которые в дальнейшем используются в различных отраслях промышленности для производства различных продуктов и материалов.
Вопрос-ответ

Какие металлы могут взаимодействовать с галогенами?
Галогены могут взаимодействовать с широким спектром металлов, включая такие элементы, как натрий, калий, магний, алюминий и многие другие.
Какие основные особенности взаимодействия галогенов с металлами можно выделить?
Одним из основных особенностей взаимодействия галогенов с металлами является образование ионных соединений, в которых галогены выступают в качестве отрицательных ионов, а металлы – в качестве положительных ионов. Также стоит отметить, что это взаимодействие может протекать с выделением большого количества энергии и может быть сопровождаться реакцией горения.
Какова структура ионных соединений металл-галоген?
Ионные соединения металл-галоген имеют кристаллическую структуру, в которой металлы образуют положительно заряженную кристаллическую решетку, а галогены располагаются в промежутках между металлическими ионами.
Какие свойства имеют ионные соединения металл-галоген?
Ионные соединения металл-галоген обладают рядом характерных свойств, таких как высокая температура плавления и кипения, хорошая электропроводность в расплавленном или растворенном состоянии, хрупкость в твердом состоянии, способность образовывать кристаллические решетки и др.
Какие примеры можно привести взаимодействия галогенов с металлами в жизни?
Примерами взаимодействия галогенов с металлами в жизни могут служить такие явления, как горение металлов в хлорной атмосфере или образование ионных соединений металл-галоген в различных химических реакциях.
