Галогениды щелочных металлов представляют собой класс химических соединений, формируемых щелочными металлами и галогенами – фтором, хлором, бромом, иодом и астатом. Эти соединения имеют широкое применение в различных отраслях промышленности, а также обладают уникальными физическими и химическими свойствами.
Галогениды щелочных металлов обладают высокой степенью растворимости в воде и других полярных растворителях. Их растворы обладают высокой электропроводностью и являются хорошими электролитами. Это делает их полезными в различных электрохимических процессах, таких как электролиз или гальваническое осаждение металлов.
Галогениды щелочных металлов также являются важными сырьевыми компонентами в производстве различных химических веществ. Например, галогениды натрия и калия широко используются в производстве стекла, керамики и мыла. Они также используются в процессе гальванического покрытия, производстве фармацевтических препаратов и в других отраслях промышленности.
Стоит отметить, что галогениды щелочных металлов обладают высокой токсичностью и опасны для здоровья человека. При работе с этими соединениями необходимо соблюдать соответствующие меры предосторожности и использовать индивидуальную защиту.
Щелочные металлы и их галогениды

Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают химической активностью, в основном, из-за низкой энергии ионизации.
Галогениды щелочных металлов - это соединения, образующиеся при взаимодействии щелочных металлов с галогенами (фтором, хлором, бромом, йодом и астатом). Галогениды щелочных металлов обычно имеют формулу MX, где M обозначает щелочный металл, а X - галоген. Например, NaCl, LiBr и KI являются примерами галогенидов щелочных металлов.
Галогениды щелочных металлов обладают рядом интересных свойств. Во-первых, они обычно являются ионами, в которых металл имеет положительный заряд, а галоген - отрицательный. Такие ионы называются галогенид-ионами. Именно благодаря такому строению галогениды щелочных металлов обладают высокой растворимостью в воде.
Во-вторых, галогениды щелочных металлов имеют высокую температуру плавления и кипения. Например, NaCl плавится при температуре 801 градус Цельсия, а кипит при 1413 градусах Цельсия. Это свойство делает галогениды щелочных металлов полезными в таких областях, как производство стекла и легирование металлов.
Некоторые галогениды щелочных металлов также обладают интересными свойствами в области оптики. Например, галогенид калия (KCl) может использоваться для создания оптических компонентов, таких как линзы и призмы, благодаря своей прозрачности в инфракрасной области спектра.
Свойства галогенидов щелочных металлов
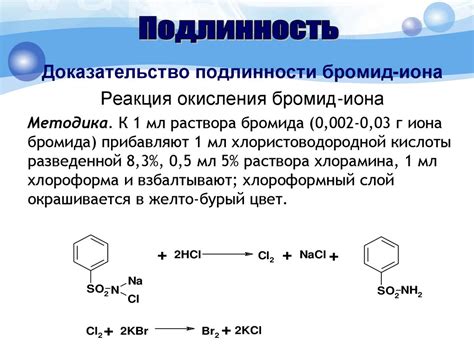
Галогениды щелочных металлов являются химическими соединениями, содержащими один из галогенов (фтор, хлор, бром, иод) и один из щелочных металлов (литий, натрий, калий, рубидий, цезий).
Одно из основных свойств галогенидов щелочных металлов - их растворимость в воде. Большинство галогенидов щелочных металлов очень хорошо растворяются в воде, образуя соли, которые принято называть гидратами. Они образуют кристаллические структуры с хорошо развитыми кристаллическими гранями и плоскостями.
Галогениды щелочных металлов также обладают высокой электропроводностью. Это связано с тем, что галогенидные ионы обладают отрицательным зарядом, а щелочные металлы имеют положительный заряд. Это позволяет галогенидам щелочных металлов быть электролитами и проводить электрический ток в растворе.
Кроме того, галогениды щелочных металлов обладают высокой термической и химической стабильностью. Они устойчивы к высоким температурам и не подвержены окислению, что делает их полезными в различных промышленных процессах, таких как производство стекла, электролитических растворов и других соединений.
Также стоит отметить, что галогениды щелочных металлов имеют высокую агрегационность и образуют сложные соединения с другими веществами, что позволяет им применяться в различных областях, включая медицину, аналитическую химию и промышленность.
Примеры галогенидов щелочных металлов

Галогениды щелочных металлов - это соединения щелочных металлов с галогенами, такими как фтор, хлор, бром и йод. Эти соединения имеют важное значение в различных областях науки и технологии.
Примером галогенида щелочного металла является хлорид натрия (NaCl). Это одно из наиболее распространенных и хорошо известных соединений. Хлорид натрия используется в пищевой промышленности, медицине, химической промышленности и других отраслях. Он также является ключевым компонентом поваренной соли.
Еще одним примером галогенида щелочного металла является фторид калия (KF). Фторид калия применяется в стекольной промышленности, где он служит флюсом для снижения температуры плавления стекла и облегчения процесса формования. Он также используется в производстве электролитов для литиевых ионных аккумуляторов.
Еще одним примером галогенида щелочного металла является бромид лития (LiBr). Бромид лития широко используется в химической промышленности, в фотографии и в медицине. Он также используется в холодильной технике для абсорбции воды в процессе охлаждения.
Имея различные свойства и широкий спектр применений, галогениды щелочных металлов являются важными соединениями в различных областях и продолжают привлекать внимание исследователей и промышленности.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что такое галогениды щелочных металлов?
Галогениды щелочных металлов - это соединения щелочных металлов с галогенами (фтором, хлором, бромом, йодом, астатом). Они обладают характерными свойствами и широко используются в различных областях науки и техники.
Какие примеры галогенидов щелочных металлов существуют?
Примерами галогенидов щелочных металлов являются: хлорид лития (LiCl), фторид натрия (NaF), бромид калия (KBr), йодид рубидия (RbI) и астатид цезия (CsAt).
Какие свойства характерны для галогенидов щелочных металлов?
Галогениды щелочных металлов обычно являются бесцветными или белыми кристаллами, хорошо растворимыми в воде. Они обладают высокой температурой плавления и кипения, а также хорошей электропроводностью. Большинство галогенидов щелочных металлов обладают сильным солевым вкусом и могут быть ядовитыми при попадании в организм.
