Фосфор — один из самых важных химических элементов, который играет существенную роль в жизни всех живых организмов на Земле. Он часто ассоциируется со щелочными металлами из-за своего положения в периодической системе элементов, однако его физические и химические свойства довольно сильно отличаются от щелочных металлов.
Фосфор (P) находится в пяти группе периодической системы элементов, вместе с другими полуметаллами и неметаллами, такими как арсен (As) и антимон (Sb). Он обладает химическими свойствами, похожими на свойства серы (S), селена (Se) и теллура (Te), и часто рассматривается как аналог этих элементов.
Основные формы фосфора - белый, красный и черный - обладают разными свойствами и применяются в разных отраслях промышленности. Белый фосфор является очень реакционным и непрактичным для использования, поэтому его заменили красным фосфором, который менее токсичен и устойчив к окислению. Черный фосфор, в свою очередь, обладает уникальными электронными свойствами и применяется, например, в полупроводниковой электронике.
Фосфор: основной или щелочной металл?

Фосфор — элемент химической таблицы, обладающий атомным номером 15 и химическим символом P. Он является многочисленными аллотропными модификациями, такими как белый, красный и черный фосфор.
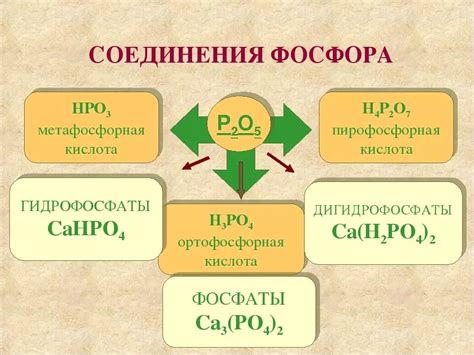
Способность фосфора образовывать ионы отрицательного заряда, его химические свойства и положение в периодической системе элементов свидетельствуют о том, что он может рассматриваться как щелочной металл. Щелочные металлы образуют оксиды, соединения с кислородом, обладающие щелочными свойствами. Аналогично, фосфор может образовывать соединения с кислородом, такие как трехокись фосфора (P4O6) и пятиокись фосфора (P4O10), которые реагируют щелочью, образуя растворимые соли.
Однако в связи с разными степенями окисления, фосфор может образовывать и кислотные соединения и растворяться в кислотах, что свойственно для элементов неметаллического характера. Это позволяет рассматривать фосфор еще и как представителя группы неметаллов.
Таким образом, фосфор можно считать как основным, так и щелочным металлом, в зависимости от точки зрения его свойств и положения в периодической системе элементов.
Физические свойства фосфора

1. Агрегатное состояние: Фосфор является химическим элементом, который может существовать в разных аллотропных формах. При обычных условиях он представлен в виде главным образом белого или желтого жесткого твердого вещества.
2. Температура плавления и кипения: Температура плавления фосфора зависит от его аллотропной формы и составляет примерно 44 градуса Цельсия. Он не кипит при обычных условиях, а просто испаряется.
3. Способность к горению: Фосфор является очень горючим веществом. Он может самовозгораться на воздухе и может гореть с ярким пламенем. При горении фосфора выделяются огненные снаряды и характерный запах.
4. Электрические свойства: Фосфор является полупроводником электричества. Он обладает определенной электропроводностью, которая зависит от его состояния и особенностей структуры.
5. Плотность и молярная масса: Плотность фосфора составляет около 1,82 г/см3, а его молярная масса равна примерно 31,0 г/моль.
6. Растворимость: Фосфор трудно растворяется в воде и некоторых органических растворителях. Однако, он может растворяться в различных кислотах и щелочах.
7. Магнитные свойства: Фосфор не обладает магнитными свойствами и не является магнетиком.
8. Оптические свойства: Фосфор имеет светоотражающую способность, что делает его подходящим для использования в различных оптических иллюзиях и фосфоресцирующих материалах.
Химические свойства фосфора

Фосфор – химический элемент, который обладает многочисленными уникальными свойствами. Он представляет собой непрозрачный твердый вещество желтого цвета, обладающее характерным запахом. Фосфор является активным элементом и образует множество соединений с другими элементами.
Основное свойство фосфора – его способность с легкостью гореть на воздухе. При этом образуется оксид фосфора (P2O5), который обладает кислотными свойствами. Именно поэтому фосфор может использоваться для получения различных фосфорных кислот.
Фосфор также обладает свойствами оксиданта. Он может взаимодействовать с многими металлами, образуя фосфиды – соединения, которые можно использовать в процессе производства сплавов и специальных материалов.
Еще одним важным свойством фосфора является его способность вступать в реакцию с кислородом, образуя оксиды фосфора различной степени окисления. Это свойство позволяет использовать фосфор в процессе получения различных фосфорных солей и органических соединений, которые находят применение в медицине и сельском хозяйстве.
Применение фосфора в промышленности

Фосфор, один из самых распространенных элементов в природе, имеет широкое применение в различных отраслях промышленности.
В первую очередь, фосфор используется для производства удобрений. Фосфаты, такие как тройной и суперфосфат, являются основным источником фосфора для растений. Они способствуют улучшению питательности почвы и повышению урожайности.
Обширное применение фосфора находит также в производстве стекла и керамики. Фосфорные соединения добавляются в композицию стекловидных и керамических материалов, чтобы придать им особые свойства, такие как прозрачность, водоотталкивающие или теплоизоляционные свойства.
Фосфорные соединения также используются в производстве огнезащитных материалов. Они способны подавлять горение и предотвращать распространение огня. Вместе с тем, они применяются в производстве герметизирующих материалов, таких как клеи и герметики, а также в производстве пластиковых и резиновых изделий.
Фосфорные соединения также находят применение в производстве дезинфицирующих средств и средств гигиены. Они являются основными компонентами многих моющих и дезинфицирующих средств. Благодаря своим антисептическим свойствам, фосфор обеспечивает эффективную борьбу с микроорганизмами и защиту от инфекций.
В итоге, фосфор имеет широкое применение в промышленности и является важным элементом в производстве удобрений, стекла, керамики, огнезащитных материалов, дезинфицирующих средств и других продуктов.
Значение фосфора для живых организмов

Фосфор является одним из важнейших элементов в организме живых существ, играющим ключевую роль в множестве жизненно важных процессов.
Он является необходимым компонентом для образования ДНК и РНК - основных нуклеиновых кислот, которые отвечают за передачу генетической информации и синтез белков. Без фосфора невозможно правильное функционирование клеточных мембран и энергетического обмена в организме.
Фосфор также является неотъемлемой составной частью аденозинтрифосфата (АТФ) - основного энергетического носителя в клетках. Он участвует в биосинтезе АТФ, обеспечивая энергией все процессы жизнедеятельности организма.
Кроме того, фосфор играет важную роль в образовании и укреплении костей и зубов. Он является ключевым компонентом гидроксиапатита - основного минерала, обеспечивающего прочность и твердость костной ткани.
Недостаток фосфора может приводить к нарушению пищеварения, аппетита, слабости и отставанию в росте. Однако избыток фосфора также имеет негативное влияние на организм, способствуя развитию заболеваний почек, кальцийной дефицитной кариеса и нарушениям обмена веществ.
Роль фосфора в природе

Фосфор - это необходимый химический элемент, играющий важную роль в природе. Он является одним из основных компонентов ДНК, РНК и АТФ, ответственных за передачу наследственной информации и энергетические процессы в клетках организмов.
Растения используют фосфор в процессе фотосинтеза для синтеза и накопления энергии в виде АТФ. Он также является важным компонентом многих белков и ферментов, необходимых для обмена веществ и роста растений. Фосфор играет решающую роль в фосфорных круговоротах, переходя из почвы в растения и затем в животных.
Животные тоже нуждаются в фосфоре для поддержания здоровья и нормального функционирования. Он является важным элементом в составе костей и зубов, обеспечивая им прочность и стабильность. Фосфор также участвует в обмене веществ, регулирует фосфорно-кальциевый обмен и нормализует работу нервной системы и мышц.
Фосфор имеет большое значение для обитателей водных экосистем. Он является важной частью водорослей, фитопланктона и зоопланктона, которые служат основой пищевой цепи для рыб и других водных организмов. Фосфор также играет важную роль в экологическом балансе водных систем.
Человек получает фосфор с пищей, включая продукты животного и растительного происхождения. Фосфор в организме человека играет роль в обмене веществ, поддерживает здоровье костей и зубов, регулирует уровень кислотности крови и участвует в работе нервной системы.
Таким образом, фосфор выполняет важные функции в природе, обеспечивая жизнедеятельность организмов и поддерживая экологический баланс. Его роль в нашей жизни трудно переоценить, так как он связан с основными биологическими процессами и нашим здоровьем.
Источники фосфора и его добыча
Фосфор является одним из самых важных элементов для жизни на Земле. Его присутствие необходимо для роста и развития растений, а также для образования ДНК и РНК. Источники фосфора могут быть различными, включая природные и искусственные источники.
В природе фосфор находится главным образом в виде фосфатов, которые представляют собой минеральные соединения. Основные источники фосфорных руд включают апатиты, которые являются основным сырьем для добычи фосфатов. Апатиты находятся в таких странах, как Китай, США, Марокко, Южная Африка и другие.
Добыча фосфатов происходит путем разработки фосфоритов, которые содержатся в апатитах. Процесс добычи включает в себя бурение и взрывание, а затем извлечение фосфатов из руды с помощью флотации и других технологий.
Кроме природных источников, фосфор также можно получить из искусственных источников, таких как фосфорные удобрения и промышленные отходы. Фосфорные удобрения, такие как суперфосфаты, производятся путем обработки фосфатных руд с добавлением кислот, что позволяет извлечь фосфор в более доступной форме для растений. Промышленные отходы, такие как зола от сжигания угля или фосфатные шламы, также содержат фосфор и могут быть использованы в производстве.
Вопрос-ответ

Является ли фосфор щелочным металлом?
Нет, фосфор не является щелочным металлом. Щелочные металлы - это элементы первой группы периодической таблицы, а фосфор относится к группе нещелочных элементов. Он принадлежит к группе пневмофоров.
В чем заключается химический состав фосфора?
Химический состав фосфора включает один атом симметризованного кристаллического фосфора и два атома черного фосфора со стандартной атомной массой 30.97376.
Какие свойства имеет фосфор?
Фосфор является химическим элементом, который обладает несколькими свойствами. Он легко воспламеняется при контакте с воздухом, образуя оксид фосфора. Он имеет ряд аллотропных форм, таких как красный, белый, черный и фиолетовый фосфор, которые обладают различными свойствами и структурой. Фосфор применяется в производстве удобрений, огнестойких материалов, фосфорсодержащих соединений и даже в противогрибковых препаратах.
Каково происхождение фосфора?
Фосфор является довольно распространенным химическим элементом, который в природе обычно присутствует в виде минерала фосфорита. Происхождение фосфора связано с последствиями вулканической активности и эрозии, при которых фосфориты высвобождаются из горных пород. Оружие из фосфорита было использовано в различные времена и в различных регионах для производства огнеопасных материалов.
