Фосфор – химический элемент с атомным номером 15 и обозначением P. Он находится в третьей периоде периодической таблицы и принадлежит к группе 15, также известной как группа азота или группа пентелей. Фосфор – один из самых распространенных элементов в природе и широко используется в различных областях, включая сельское хозяйство, медицину, электронику и промышленность.
Фосфор является неметаллом и обладает химическими свойствами, присущими этому классу элементов. Он образует различные оксиды, включая высший оксид – фосфорный пятооксид (P4O10). Фосфорный пятооксид – это мощный окислитель и используется в различных химических реакциях, включая синтез органических соединений и производство удобрений.
Формула фосфорного пятооксида – P4O10 – указывает, что он состоит из 4 атомов фосфора и 10 атомов кислорода. Этот оксид является кислотным и может реагировать с водой, образуя фосфорную кислоту. Фосфорный пятооксид также используется в производстве стекла, керамики и различных химических соединений.
Период в таблице Менделеева
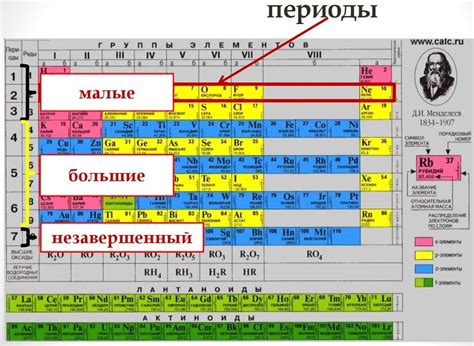
В таблице Менделеева период - это горизонтальный ряд элементов, расположенных в порядке возрастания атомного числа. Заполнение электронных оболочек элементов происходит по принципу, согласно которому каждая новая группа элементов заполняет следующий энергетический уровень вокруг атомного ядра.
Периоды таблицы Менделеева обозначаются числами от 1 до 7. В первом периоде находятся два элемента: водород (H) и гелий (He). Они имеют по одной электронной оболочке. Второй период содержит восемь элементов: литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F) и неон (Ne). У этих элементов две заполненные электронные оболочки.
Каждый новый период начинается с новой электронной оболочки. Так, в третьем периоде находятся элементы натрий (Na), магний (Mg), алюминий (Al), кремний (Si), фосфор (P), сера (S), хлор (Cl) и аргон (Ar). У них уже три электронные оболочки.
Периоды таблицы Менделеева имеют особые свойства, так как элементы, расположенные в одном периоде, имеют одинаковое количество электронных оболочек и похожую химическую активность. По мере перемещения по периодам, размер атомов и электроотрицательность элементов изменяются, что влияет на их химические свойства и возможность образования соединений.
Группа в таблице Менделеева
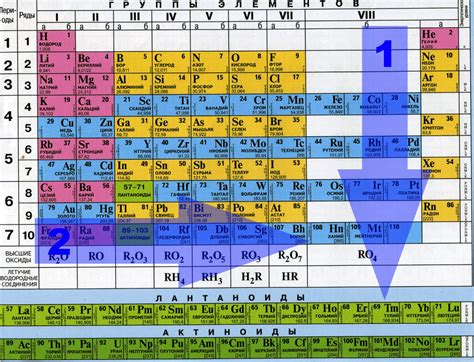
Группа в таблице Менделеева определяет химические свойства химических элементов. Под группой понимается вертикальная колонка в таблице, нумерация которых варьируется от 1 до 18. Всего в таблице 18 групп.
Группы в таблице Менделеева помогают установить общие закономерности в свойствах химических элементов. В одной группе находятся элементы с схожими электронными конфигурациями, что влияет на их химическую активность и реакционную способность.
Группа элементов может иметь общую формулу оксида. Например, восьмая группа, куда входит фосфор, образует оксид с формулой P2O5. Этот оксид является высшим оксидом фосфора в восьмой группе. Он представляет собой бинарное соединение фосфора и кислорода, где на каждый атом фосфора приходится два атома кислорода.
Группы в таблице Менделеева также имеют свое название. Например, первая группа называется щелочными металлами, а восьмая группа - кислородосодержащими неметаллами. Называя элементы по группам, мы можем легко определить их общие характеристики и свойства.
Фосфор: металл или неметалл?
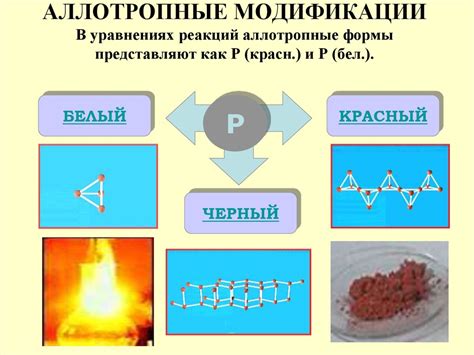
Фосфор - химический элемент, который может существовать в различных формах: белый, красный, черный и фиосфор. Самый распространенный - белый фосфор. Высокая полиморфия фосфора объясняется его способностью образовывать различные структуры кристаллической решетки. Он является тетраатомным молекулярным веществом с формулой P4.
Фосфор находится в 15-й группе периодической таблицы, где находятся неметаллы. Это группа, в которой находятся элементы, обладающие характерными неметаллическими свойствами. Фосфор - это многозначный элемент, который может образовывать ионные соединения с разным зарядом, а также молекулярные соединения.
Таким образом, можно сказать, что фосфор является неметаллом. Он обладает характерными неметаллическими свойствами, такими как низкая температура плавления и кипения, хрупкость, неспособность проводить электрический ток. В то же время он обладает высокой реакционной способностью и может образовывать ионные соединения с металлами.
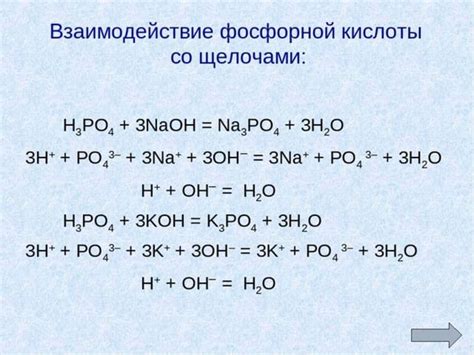
Высший оксид фосфора, или оксид фосфора(V), имеет формулу P2O5. Этот оксид является кислотным и реагирует с водой, образуя ортофосфорную кислоту. Отсюда следует, что фосфор - это неметалл, образующий кислотные оксиды, что подтверждает его неметаллический характер.
Структура фосфора
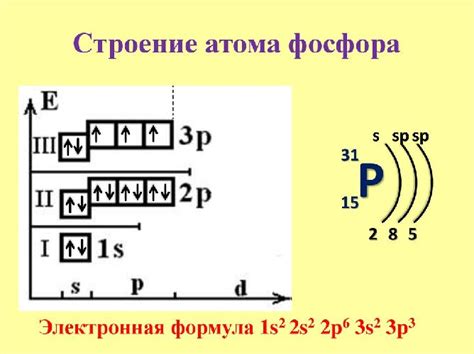
Фосфор — химический элемент с атомным номером 15. Он относится к группе P15 периодической системы элементов и имеет атомную массу около 31, его символ - P. Фосфор может существовать в разных модификациях, таких как белый, красный и черный, которые отличаются своей структурой и свойствами.
Белый фосфор - наиболее распространенная и стабильная форма фосфора при нормальных условиях. Он образует молекулы семиатомного размера, которые образуют трехмерную кристаллическую решетку. Такая структура позволяет белому фосфору быть мягким и восприимчивым к давлению и температуре.
Красный фосфор - модификация, которая возникает при нагревании или механическом воздействии на белый фосфор. В отличие от белого, красный фосфор образует молекулы бесконечной длины. Он имеет полупроводниковые свойства и используется в радиотехнике и электронике.
Черный фосфор - наиболее экзотическая форма фосфора, которая была открыта недавно. У него гексагональная структура, состоящая из двухмерных слоев атомов фосфора. Черный фосфор является полупроводником и обладает уникальными физическими свойствами, что может найти применение в электронике и оптике.
Свойства фосфора
Фосфор – химический элемент с атомным номером 15 и обозначением P. Он относится к группе 15 периодической таблицы, также известной как группа азота. Фосфор является неметаллом и находится в третьем периоде таблицы.
Фосфор обладает несколькими уникальными свойствами. Один из его важных химических характеристик – возможность образования оксидов фосфора. Высший оксид фосфора, известный как оксид фосфора(V), имеет формулу P2O5. Он является мощным окислителем и используется в различных химических процессах.
Вследствие наличия множества аллотропных форм, фосфор может существовать в различных состояниях: белый, красный, черный и фиолетовый фосфор. Белый фосфор – наиболее распространенная аллотропная форма – обладает свойствами ядовитого вещества. Красный фосфор является более стабильной и менее реактивной формой, которая не является токсичной. Черный фосфор – самый непростой из всех аллотропных форм, он обладает полупроводниковыми свойствами и стабилен при высоких температурах.
Основное назначение фосфора в современном обществе – производство промышленных удобрений. Фосфорные соединения используются для повышения плодородия почв и улучшения качества растений. Благодаря этому фосфор важен для сельского хозяйства и сельскохозяйственных производств. Кроме того, фосфор играет важную роль в биологических процессах, таких как передача генетической информации, фосфорилирование белков и энергетический метаболизм.
Формула высшего оксида фосфора
Фосфор является химическим элементом, который находится в пятой группе периодической системы и обозначается символом P. Этот элемент является неметаллом, и у него имеется несколько оксидов. Один из самых известных и широко распространенных оксидов фосфора - это высший оксид.
Формула высшего оксида фосфора обозначается как P4O10. Этот оксид представляет собой бесцветные кристаллические соединения, которые образуются при сжигании фосфора в кислороде. Формула P4O10 указывает на то, что в молекуле этого оксида присутствуют четыре атома фосфора и десять атомов кислорода.
Высший оксид фосфора является одним из наиболее распространенных оксидов этого элемента. Он обладает высокой реакционной способностью и используется во многих химических процессах и промышленных производствах. Этот оксид также имеет важное значение в области органической химии, где он используется в синтезе различных соединений.
Выводя формулу высшего оксида фосфора, P4O10, можно сделать вывод, что это соединение содержит четыре атома фосфора и десять атомов кислорода. Такое соотношение атомов в молекуле является характерным для высшего оксида фосфора и определяет его свойства и реакционную способность.
Применение фосфора в научных и промышленных целях
Фосфор является химическим элементом, который широко применяется в научных и промышленных целях благодаря своим уникальным свойствам. Фосфор, обозначаемый символом P, находится в пятой группе периодической системы элементов и относится к неметаллам.
Фосфор обладает высокой активностью и способностью к реакциям с другими элементами, что делает его идеальным компонентом для различных промышленных процессов. Основные формы фосфора включают белый, красный и черный фосфор. Белый фосфор является самым распространенным и используется в производстве множества продуктов.
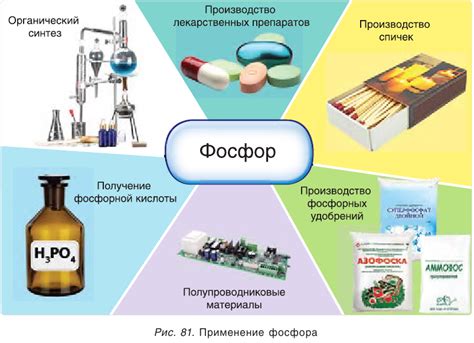
Фосфор, прежде всего, используется в производстве удобрений. Он является одним из основных элементов, необходимых растениям для их роста и развития. Фосфорные удобрения позволяют улучшить плодородность почвы и увеличить урожайность сельскохозяйственных культур.
Кроме того, фосфор применяется в производстве различных химических соединений и продуктов. Например, он используется для производства фосфатных удобрений, стекла, мыла и моющих средств, фосфорной кислоты, а также фармацевтических препаратов.
Фосфор также имеет широкое применение в производстве легких сплавов, таких как алюминий. Он добавляется в сплавы для улучшения их прочности и стойкости к коррозии. Фосфорный материал также используется в производстве зубных паст, огнетушителей, аккумуляторов и даже сигаретных спичек.
Таким образом, фосфор играет важную роль в различных отраслях науки и промышленности. Его уникальные свойства делают его ценным компонентом для производства различных продуктов и соединений, которые широко используются в повседневной жизни.
Вопрос-ответ

Какой период у фосфора в периодической системе?
Фосфор находится в третьем периоде периодической системы.
В какой группе расположен фосфор?
Фосфор расположен в пятой группе периодической системы.
Является ли фосфор металлом или неметаллом?
Фосфор является неметаллом.
Какая формула высшего оксида фосфора?
Формула высшего оксида фосфора - P2O5.
Где встречается фосфор в природе?
Фосфор встречается в природе в виде минералов, таких как апатиты и фосфориты, а также в органических соединениях.
