Оксиды щелочных металлов являются одними из самых распространенных и важных соединений в химии. Они состоят из щелочного металла и кислорода, и могут иметь различные степени окисления. Оксиды щелочных металлов широко применяются в промышленности, медицине и научных исследованиях.
Высшие оксиды щелочных металлов содержат большую концентрацию кислорода и имеют более высокую степень окисления, чем их низшие аналоги. Каждый щелочный металл имеет свои собственные формулы высших оксидов, которые определяются электрохимическими свойствами элемента. Например, для натрия самым известным высшим оксидом является пероксид натрия с формулой Na2O2, а для калия - супероксид калия с формулой KO2.
Высшие оксиды щелочных металлов имеют ряд уникальных свойств, которые позволяют им использоваться в различных областях науки и промышленности. Например, пероксид натрия используется как кислородный источник в жидкой ракетной топливе, а супероксид калия применяется в дыхательных аппаратах. Кроме того, высшие оксиды щелочных металлов играют важную роль в окислительно-восстановительных реакциях и каталитических процессах.
Формулы высших оксидов щелочных металлов

Высшие оксиды щелочных металлов представляют собой химические соединения, состоящие из кислорода и щелочного металла. Оксиды щелочных металлов обладают высокой электроотрицательностью, что позволяет им образовывать сильно щелочные растворы в воде.
Формулы высших оксидов щелочных металлов обычно составляются путем указания химического символа щелочного металла и числа, обозначающего количество атомов кислорода. Например, химическая формула пероксида натрия - Na2O2.
Оксиды щелочных металлов обладают различными свойствами и находят широкое применение. Например, пероксид бария (BaO2) применяется в качестве окислителя в химической промышленности, а пероксид калия (K2O2) используется в медицине как антисептическое средство.
Важно отметить, что формулы высших оксидов щелочных металлов могут иметь разные варианты, в зависимости от степени окисления щелочного металла. Например, для калия существуют два следующих варианта: K2O и K2O2.
Информация о формулах и составе оксидов

Формулы высших оксидов щелочных металлов включают следующие элементы:
- Оксид натрия (Na2O) - состоит из атомов натрия (Na) и кислорода (O). Этот оксид является основным и обладает щелочными свойствами.
- Оксид калия (K2O) - состоит из атомов калия (K) и кислорода (O). Он также является основным и проявляет щелочные свойства.
- Оксид лития (Li2O) - состоит из атомов лития (Li) и кислорода (O). Этот оксид обладает щелочными свойствами и применяется в производстве литиевых аккумуляторов.
В формулах оксидов щелочных металлов кислород (O) обычно присутствует в виде диоксида (O2), то есть каждый атом металла соединяется с двумя атомами кислорода.
Информация о формулах и составе оксидов щелочных металлов представлена в таблице:
| Щелочный металл | Формула оксида | Состав оксида |
|---|---|---|
| Натрий | Na2O | 2Na + O2 |
| Калий | K2O | 2K + O2 |
| Литий | Li2O | 2Li + O2 |
Знание формул и состава оксидов щелочных металлов является важным для понимания их химических свойств и применения в различных отраслях науки и промышленности.
Какие элементы входят в состав щелочных металлов
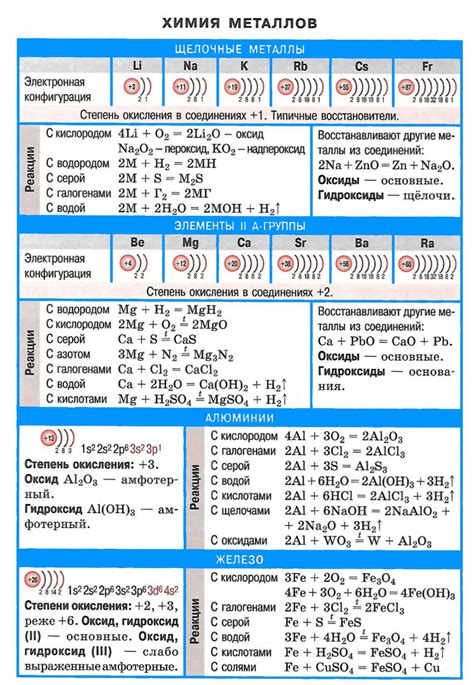
Щелочные металлы – это группа элементов, которые находятся в первой группе периодической системы химических элементов. В их состав входят следующие элементы:
- Литий (Li): это мягкий и легкий металл, который обладает низкой плотностью. Литий используется в батареях, керамике, лекарствах и других отраслях промышленности.
- Натрий (Na): натрий является реактивным металлом, который встречается в природе только в соединениях. Он широко используется в производстве стекла, щелочей и многих других химических соединений.
- Калий (K): калий – мягкий и серебристо-белый металл, который оказывает большое влияние на растения и животных. Он используется в производстве удобрений и как электролит в батареях.
- Рубидий (Rb): рубидий является мягким и серебристым металлом, который обладает насыщенно-красным оттенком при нагревании. Он используется в научных исследованиях, в производстве оптических стекол и в других отраслях промышленности.
- Цезий (Cs): цезий – очень реактивный и мягкий металл, который легко реагирует с водой. Он используется в научных исследованиях, в производстве атомных часов и в других высокотехнологичных отраслях.
- Франций (Fr): франций является самым редким и наиболее реактивным щелочным металлом. Он очень редко встречается в природе и его химические свойства плохо изучены.
Все щелочные металлы хорошо растворимы в воде и образуют цветные соединения. Они отличаются низкой плотностью, низкой температурой плавления и высокой реактивностью. Щелочные металлы играют важную роль в различных отраслях промышленности и науки.
Формулы и свойства оксидов щелочных металлов

Оксиды щелочных металлов представляют собой соединения, состоящие из соответствующего щелочного металла и кислорода. Их формулы выражают соотношение атомных частей металла и кислорода в соединении.
Оксиды щелочных металлов обычно обладают химической формулой MO, где M - символ щелочного металла. Самыми распространенными щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Соответственно, их основные оксиды имеют формулы Li2O, Na2O, K2O, Rb2O и Cs2O.
Щелочные оксиды обладают рядом важных свойств. Во-первых, они являются щелочными растворителями и проявляют щелочные свойства в водных растворах, образуя гидроксиды щелочных металлов. Во-вторых, щелочные оксиды обладают высокой реакционной способностью и могут реагировать с различными веществами, например, с кислотами, образуя соли. Кроме того, они могут использоваться в синтезе различных соединений.
Список оксидов щелочных металлов можно представить в виде таблицы:
| Щелочный металл | Формула оксида |
|---|---|
| Литий | Li2O |
| Натрий | Na2O |
| Калий | K2O |
| Рубидий | Rb2O |
| Цезий | Cs2O |
Выводя формулы оксидов щелочных металлов и изучая их свойства, мы можем узнать основные характеристики этих соединений и их применение в различных областях науки и техники.
Высшие оксиды щелочных металлов: свойства и применение

Высшие оксиды щелочных металлов являются соединениями, которые образуются при окислении щелочных металлов. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают способностью образовывать различные оксиды в зависимости от степени окисления.
Формулы высших оксидов щелочных металлов обычно имеют вид M2O, где M обозначает щелочный металл. Так, для лития высший оксид будет иметь формулу Li2O, для натрия - Na2O, а для калия - KO. Отличительной особенностью этих соединений является наличие высшей степени окисления щелочных металлов.
Свойства высших оксидов щелочных металлов включают высокую термическую стабильность, хорошую проводимость электричества и тепла, а также растворимость в воде и других поларных растворителях. Эти оксиды обладают щелочными свойствами и способны реагировать с кислородом, образуя гидроксиды.
Высшие оксиды щелочных металлов имеют широкое применение в различных областях. Они используются в производстве стекла, керамики, электронных компонентов, а также в качестве катализаторов в химической промышленности. Кроме того, эти оксиды находят применение в производстве щелочных элементов, аккумуляторов и других электрохимических устройств.
Выводящиеся в атмосферу высшие оксиды щелочных металлов могут вызывать окружающую среду и здоровье людей. В связи с этим проводятся исследования по разработке методов утилизации и очистки промышленных выбросов, а также по снижению содержания вредных веществ в производственных процессах.
Оксиды щелочных металлов в природе

Оксиды щелочных металлов - это химические соединения, состоящие из кислорода и металлического элемента щелочной группы периодической системы. В природе такие оксиды встречаются в большом количестве и являются важными минералами.
Одним из известных оксидов щелочных металлов является оксид калия, который имеет химическую формулу K2O. Этот оксид представляет собой белый кристаллический порошок и широко используется в различных отраслях промышленности, включая производство стекла, мыла и удобрений.
Еще одним из наиболее распространенных оксидов щелочных металлов является оксид натрия, химическая формула которого Na2O. Он представляет собой белый гигроскопичный порошок, который вступает в реакцию с водой, образуя щелочную соль.
Другим известным природным оксидом щелочных металлов является оксид лития, химическая формула которого Li2O. Этот оксид представляет собой бесцветные кристаллы, которые широко используются в производстве аккумуляторов и стеклянных изделий.
Изучение оксидов щелочных металлов в природе позволяет не только понять их физические и химические свойства, но и применить их в различных областях науки и промышленности.
Структура высших оксидов щелочных металлов

Оксиды щелочных металлов – это соединения, состоящие из атомов щелочных металлов (например, лития, натрия, калия) и кислорода. Высшие оксиды щелочных металлов имеют сложную структуру и обладают интересными свойствами.
Структура высших оксидов щелочных металлов определяется способом, которым кислородные атомы связываются с атомами металла. В большинстве случаев оксиды щелочных металлов образуют кристаллические структуры.
Содержание кислорода в оксидах щелочных металлов определяет их стехиометрическую формулу. Например, в оксиде лития (Li2O) каждый атом лития связан с двумя атомами кислорода, а в оксиде калия (K2O) каждый атом калия связан с одним атомом кислорода.
Существуют различные типы кристаллических структур высших оксидов щелочных металлов. Например, оксид натрия (Na2O) образует кристаллическую структуру типа куба, а оксид калия (K2O) – кристаллическую структуру типа гексагонального ромбоедра.
Структура высших оксидов щелочных металлов играет важную роль в определении их физических и химических свойств. Например, структура может определять такие характеристики, как твердость, плотность, температуру плавления и др.
Важно отметить, что кристаллическая структура высших оксидов щелочных металлов может изменяться в зависимости от условий их синтеза или применения. Некоторые вещества могут образовывать аморфные структуры или продемонстрировать полиморфизм – способность существовать в разных кристаллических формах.
Интересные факты о высших оксидах щелочных металлов

1. Формула высшего оксида щелочного металла состоит из двух элементов: самого щелочного металла и кислорода. Каждый из щелочных металлов имеет свой высший оксид с уникальной формулой. Например, для лития это Li2O, для натрия - Na2O, для калия - K2O и так далее.
2. Высшие оксиды щелочных металлов обладают высокой реактивностью. Это связано с тем, что они образуются при реакции щелочных металлов с кислородом. Оксиды этих металлов относятся к группе оксидов щелочно-земельных металлов, которые являются сильными основаниями.
3. Высшие оксиды щелочных металлов используются в различных отраслях промышленности. Например, оксид натрия (Na2O) используется в процессе производства стекла. Как известно, стекло содержит натрий в своем составе, и оксид натрия добавляется для улучшения технологических свойств стекла. Оксид калия (K2O) применяется как катализатор в различных химических реакциях.
4. Высшие оксиды щелочных металлов также имеют медицинское применение. Оксиды лития (Li2O) и калия (K2O) используются в производстве лекарственных препаратов для лечения некоторых заболеваний. Например, оксид калия используется при производстве лекарств для лечения гиперкалиемии, а оксид лития является активным компонентом противоэпилептических препаратов.
5. Высший оксид щелочного металла может быть использован в синтезе других веществ. Например, оксид натрия может быть использован в синтезе гидроксидов натрия, сернокислого натрия и других соединений. Это позволяет получать различные продукты с разными свойствами и применениями.
Итак, высшие оксиды щелочных металлов - это важные соединения, которые находят применение в различных областях науки, промышленности и медицине.
Вопрос-ответ

Какие элементы входят в состав высших оксидов щелочных металлов?
К высшим оксидам щелочных металлов относятся оксиды, которые содержат элементы калия, натрия, лития и других щелочных металлов в высшей степени окисления с положительным зарядом.
Какие формулы имеют высшие оксиды щелочных металлов?
Высшие оксиды щелочных металлов имеют различные формулы в зависимости от конкретного металла. Например, формула пероксида калия - К2O2, оксида калия - К2O, пероксида натрия - Na2O2, оксида натрия - Na2O и т.д. Каждая формула отражает состав конкретного оксида щелочного металла.
