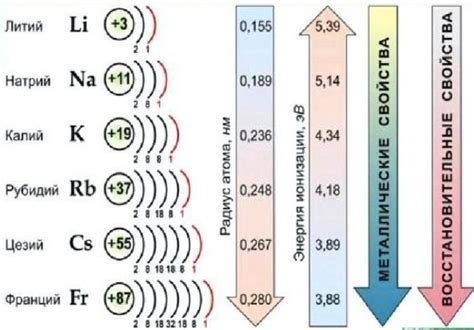
Щелочные металлы - группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются высокой реактивностью и низкой электроотрицательностью, что делает их отличными химическими реагентами.
Электронные конфигурации атомов щелочных металлов определяют, сколько электронов у атома и как они распределены в его энергетических оболочках. Все щелочные металлы имеют общую электронную конфигурацию [noble gas] ns1, где [noble gas] представляет полную электронную конфигурацию ближайшего инертного газа.
Например, электронная конфигурация лития (Li) - 1s2 2s1, где 1s2 представляет первую энергетическую оболочку с двумя электронами, а 2s1 представляет вторую энергетическую оболочку с одним электроном. Аналогично, натрий (Na) имеет электронную конфигурацию 1s2 2s2 2p6 3s1, где 1s2 2s2 2p6 представляет первые и вторую энергетические оболочки, содержащие заполненные оболочки, и 3s1 представляет третью энергетическую оболочку с одним электроном.
Таким образом, электронные конфигурации щелочных металлов помогают понять их химические свойства и реакционную способность. Они также являются важной характеристикой при изучении взаимодействий щелочных металлов с другими элементами и соединениями.
Структура электронных конфигураций атомов щелочных металлов

Электронные конфигурации атомов щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, имеют особую структуру. Щелочные металлы находятся в первой группе периодической системы элементов и характеризуются наличием одного электрона на наружном энергетическом уровне. Именно это делает их очень реакционно-способными в химических реакциях.
Электронная конфигурация атома лития, например, представляет собой 1s^2 2s^1. Здесь 1s^2 обозначает, что на первом энергетическом уровне находятся два электрона, а 2s^1 указывает на один электрон на втором энергетическом уровне. Атом натрия имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^1.
Щелочные металлы имеют общую черту - наличие одного электрона на наружном s-подуровне. Структура их электронных конфигураций позволяет им легко отдавать этот электрон во внешние химические реакции. Это объясняет высокую реакционность щелочных металлов, их способность образовывать ионы с положительным зарядом, а также высокую электропроводность и теплопроводность.
Также стоит отметить, что электронные конфигурации атомов щелочных металлов можно представить в виде периодической таблицы. Например, для лития - 1s^2 2s^1, для натрия - 1s^2 2s^2 2p^6 3s^1 и так далее. Это позволяет увидеть закономерности и общие черты в структуре электронных конфигураций щелочных металлов.
Электронная оболочка атомов щелочных металлов

Щелочные металлы обладают уникальными свойствами, которые определяются электронной оболочкой их атомов. Электронная оболочка состоит из энергетических уровней, на которых располагаются электроны. Строение этой оболочки важно для понимания химических свойств данных элементов.
Атомы щелочных металлов, таких как литий, натрий, калий и другие, имеют единственную электронную оболочку внешнего слоя, обозначаемую как s-оболочка. Она содержит один или два энергетических уровня (s-исполняющие состояния), на которых находятся электроны.
Наиболее характерным свойством щелочных металлов является их тренд к образованию ионов с положительным зарядом. Это происходит путем передачи одного электрона из внешней s-оболочки. В результате образуется ион с положительным зарядом, а число электронов на внешней оболочке уменьшается на единицу.
Электронная конфигурация атомов щелочных металлов помогает понять их реакционные способности и способность образовывать химические связи. Она также является основой для объяснения химического поведения элементов и проведения различных химических реакций с их участием.
Приведенная ниже таблица показывает электронную конфигурацию атомов щелочных металлов:
| Элемент | Электронная конфигурация |
|---|---|
| Литий (Li) | 1s22s1 |
| Натрий (Na) | 1s22s22p63s1 |
| Калий (K) | 1s22s22p63s23p64s1 |
Электронная оболочка атомов щелочных металлов является решающим фактором для их химических свойств. Это связано с наличием одного электрона на внешнем слое, что позволяет атомам этих элементов легко образовывать ионы и вступать в различные химические реакции.
Основные принципы формирования электронной конфигурации

Электронная конфигурация атома определяет распределение его электронов по энергетическим уровням и подуровням. Она основана на трех основных принципах: принципе заполнения энергетических уровней, принципе заполнения подуровней и принципе исключения Паули.
Первый принцип - принцип заполнения энергетических уровней - гласит, что электроны заполняют энергетические уровни начиная с наименьшей энергии. Для щелочных металлов, таких как литий, натрий и калий, электроны сначала заполняют первый энергетический уровень, затем второй и так далее.
Второй принцип - принцип заполнения подуровней - показывает, что электроны заполняют подуровни определенным образом. Подуровни обозначаются буквами s, p, d, f и имеют разные формы, связанные с формой орбитали. Щелочные металлы имеют электронную конфигурацию вида ns1, где n - номер энергетического уровня. Например, литий имеет электронную конфигурацию 1s2 2s1.
Третий принцип - принцип исключения Паули - говорит, что в каждой орбитали может находиться не более двух электронов с противоположными спинами. Это означает, что на каждой орбитали должно быть одно или ноль электронов. Электроны заполняют подуровни поочередно, прежде чем занимать орбитали с одинаковыми энергиями.
В заключение, электронная конфигурация атомов щелочных металлов связана с принципами заполнения энергетических уровней и подуровней, а также принципом исключения Паули. Знание электронной конфигурации позволяет понять химические свойства и реактивность данных металлов.
Изменение электронных конфигураций щелочных металлов при образовании ионов

Электронные конфигурации щелочных металлов определяют расположение и количество электронов в их атомах. Щелочные металлы, такие как литий, натрий, калий и др., имеют внешний электронный слой с одним электроном, который можно легко потерять или передать. При этом, образуются ионы с измененной электронной конфигурацией.
Процесс образования ионов у щелочных металлов связан с передачей или приемом электронов. Превращение атома щелочного металла в положительно или отрицательно заряженный ион происходит за счет изменения числа электронов на внешнем электронном слое. Литий, например, может передать свой единственный электрон, став положительно заряженным ионом (Li+), а кислород может принять два электрона, став отрицательно заряженным ионом (O2-).
Электронные конфигурации ионов щелочных металлов отличаются от конфигураций их атомов. Когда атом теряет один электрон, его ионный заряд становится положительным, и число электронов на внешнем слое уменьшается на единицу. Натрий, например, имеет электронную конфигурацию [Ne]3s1, но его положительно заряженный ион (Na+) имеет конфигурацию [Ne].
Ионизационная энергия щелочных металлов, которая определяет энергию, необходимую для отрыва электрона от атома, снижается с увеличением атомного радиуса. Это объясняет возможность легкого образования ионов щелочных металлов и их высокую реакционную способность.
Таким образом, электронные конфигурации щелочных металлов при образовании ионов изменяются в зависимости от потери или приема электронов. Это приводит к образованию ионов с другим количеством электронов на внешнем электронном слое и отличающимся зарядом.
Влияние электронной конфигурации на свойства щелочных металлов
Электронная конфигурация атомов щелочных металлов играет важную роль в определении их химических и физических свойств. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, отличаются от других элементов периодической системы своей низкой электроотрицательностью и высокой активностью.
Ключевым фактором, определяющим электронную конфигурацию щелочных металлов, является наличие одного электрона в внешней оболочке. Это делает их особенно реактивными, поскольку они стремятся избавиться от этого электрона и стать стабильными. Это приводит к тому, что щелочные металлы легко образуют ионные соединения с другими элементами.
Электронная конфигурация также определяет физические свойства щелочных металлов. Например, они обладают низкой плотностью и низкой температурой плавления и кипения. Это объясняется тем, что электронные облака щелочных металлов слабо связаны, что делает их более подвижными и мягкими.
Влияние электронной конфигурации также прослеживается в химических реакциях щелочных металлов. Их активность проявляется в реакциях с кислородом, водой и другими веществами. Однако эта активность со временем уменьшается, поскольку заряд ионов щелочных металлов повышается с увеличением атомного номера.
Таким образом, электронная конфигурация является основой для понимания свойств и химического поведения щелочных металлов. Она определяет их активность, структуру и другие характеристики. Понимание этого фактора помогает исследователям использовать щелочные металлы в различных областях, включая фармацевтику, энергетику и материаловедение.
Вопрос-ответ

Какая электронная конфигурация у атома лития?
У атома лития электронная конфигурация 1s2 2s1.
Какие атомы входят в группу щелочных металлов?
В группу щелочных металлов входят атомы лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr).
