Металлы - это вещества, обладающие хорошей тепло- и электропроводностью, благодаря чему они используются в различных отраслях промышленности. Однако металлы также имеют свойство вступать в химические реакции с окислителями, что приводит к образованию соединений металл-окись. Степень окисления металла определяет, сколько электронов он отдал окислителю. В зависимости от степени окисления различаются формулы соединений металлов.
Степень окисления металла может быть положительной, отрицательной или нулевой. Положительная степень окисления указывает на то, что металл отдал электроны, а отрицательная - что металл принял электроны. Нулевая степень окисления говорит о том, что металл не отдал и не принял электроны, то есть остался в своем исходном состоянии.
Формулы соединений металлов в зависимости от степени окисления металла могут быть различными. Например, соединения с положительной степенью окисления имеют вид "Металл+окись", например, Fe2O3 (оксид железа (III)). Соединения с отрицательной степенью окисления имеют вид "Окись+металл", например, Al2O3 (оксид алюминия). Соединения с нулевой степенью окисления можно найти, когда металл находится в свободном состоянии, например, Cu (медь).
Степень окисления в соединениях металлов
Степень окисления — это числовое значение, которое указывает на количество электронов, которые переходят с атома металла на атом кислорода при формировании соединения. Для металлов степень окисления может быть как положительной, так и отрицательной, в зависимости от того, насколько металл предоставляет или принимает электроны.
Степень окисления металла имеет важное значение при написании формул соединений металлов. Она указывает на количество электронов, которые металл отдает, и позволяет определить, сколько атомов металла требуется для удовлетворения степени окисления кислорода или другого элемента.
Например, если степень окисления металла равна +2, то это означает, что металл отдаёт два электрона и может вступать в соединение с элементами, имеющими степень окисления -2, такими как кислород. В результате получается электронно-нейтральное соединение.
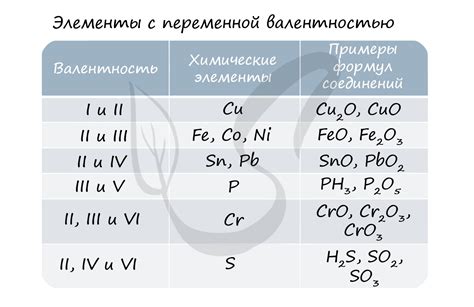
В таблице ниже приведены примеры соединений металлов с различными степенями окисления:
- Железо Fe:
- Степень окисления +2: FeO, FeCl2
- Степень окисления +3: Fe2O3, FeCl3
- Медь Cu:
- Степень окисления +1: Cu2O, CuCl
- Степень окисления +2: CuO, CuCl2
- Свинец Pb:
- Степень окисления +2: PbO, PbCl2
- Степень окисления +4: PbO2, PbCl4
Определение степени окисления металла является важным шагом при написании химических формул соединений металлов. Она позволяет определить соотношение между металлом и другими элементами в соединении и понять электронную структуру молекулы.
Какие бывают степени окисления?

Степень окисления представляет собой числовую характеристику, отражающую электронную структуру атомов в химических соединениях. Металлы, как и другие химические элементы, могут иметь различные степени окисления в соединениях.
Степень окисления металла может быть положительной, отрицательной или нулевой. Положительная степень окисления указывает на то, что металл потерял электроны и превратился в катион. Отрицательная степень окисления, наоборот, означает, что металл принял электроны и стал анионом. Нулевая степень окисления означает, что металл не потерял и не принял электроны и находится в нейтральном состоянии.
Степень окисления металла зависит от его электроотрицательности и его положения в периодической системе химических элементов. Металлы могут иметь несколько степеней окисления в различных соединениях. Например, железо может иметь степени окисления +2 и +3, медь - +1 и +2, свинец - +2 и +4 и так далее.
Знание степеней окисления металлов позволяет определить и составить формулу соединения, а также предсказать его химические свойства. Отличная химическая основа в этой области позволяет понять многие процессы химических реакций, а также принять более обоснованные решения в химической практике.
Свойства соединений с разными степенями окисления

Соединения металлов с разными степенями окисления обладают разными свойствами, которые зависят от степени окисления самого металла. Степень окисления показывает, сколько электронов отдает или принимает металл при образовании соединения.
Соединения с положительными степенями окисления металлов обычно обладают высокой электроотрицательностью и хорошей способностью к окислению других веществ. Они чаще всего образуют ионные соединения и характеризуются высокой температурой плавления и кипения, твердыми и хрупкими кристаллическими структурами. Некоторые из таких соединений имеют ярко выраженные цвета, что делает их полезными в качестве пигментов в производстве красок и косметики.
Соединения с отрицательными степенями окисления металлов обычно обладают низкой электроотрицательностью и хорошей способностью к восстановлению. Они чаще всего образуют координационные соединения, в которых металл образует комплексы с лигандами. Такие соединения обычно имеют низкую температуру плавления и кипения, мягкие и пластичные кристаллические структуры. Они также могут обладать цветом, но в большинстве случаев они бесцветные или слабо окрашены.
Свойства соединений с разными степенями окисления металлов могут быть разнообразными и зависят от конкретного металла и окружающих его атомов или ионов. Они могут использоваться в различных отраслях промышленности и науки, таких как металлургия, катализ, электроника и другие.
Формулы соединений металлов с разными степенями окисления

Степень окисления металла определяется числом, которое указывает, сколько электронов металл отдал или принял при образовании соединения. Степень окисления может быть положительной, отрицательной или нулевой.
У металлов обычно есть несколько степеней окисления, что обусловлено их электронной структурой. Каждая степень окисления соответствует определенной формуле соединения металла.
Для металлов с положительными степенями окисления, формула соединения обычно состоит из иона металла с указанием его степени окисления и аниона или нескольких анионов. Например, соединение железа(III) и хлорида будет иметь формулу FeCl3, где Fe3+ - ион железа со степенью окисления +3, а Cl- - ион хлорида.
Для металлов с отрицательными степенями окисления, формула соединения обычно состоит из ионов нескольких анионов и одного катиона металла с указанием его степени окисления. Например, соединение серебра и меди(I) оксида будет иметь формулу Ag2O, где Ag+ - ион серебра со степенью окисления +1, а O2- - ион оксида.
В случае металлов с переменными степенями окисления, формула соединения может содержать разные ионы металла с разными степенями окисления. Например, соединение марганца(IV) и марганца(II) оксида будет иметь формулу MnO2, где Mn4+ - ион марганца со степенью окисления +4, а Mn2+ - ион марганца со степенью окисления +2.
Таким образом, формулы соединений металлов с разными степенями окисления зависят от электронной структуры металла и его способности отдавать или принимать электроны.
Примеры соединений металлов с разными степенями окисления
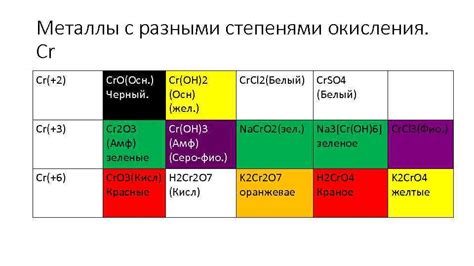
Соединения металлов с разными степенями окисления образуются при взаимодействии металла с различными веществами, такими как кислород, азот, сера и др. Знание формул таких соединений позволяет более точно предсказывать их свойства и применение.
Первый пример - соединение железа (Fe) с кислородом. Железо может иметь две степени окисления: +2 и +3. При соединении с кислородом формируются оксиды FeO и Fe2O3. Оба оксида обладают разными свойствами и применяются в различных областях, например, в качестве катализаторов, пигментов или для получения железа в металлургии.
Второй пример - соединение меди (Cu) с серой. Медь может иметь две степени окисления: +1 и +2. При соединении с серой образуются соединения Cu2S и CuS. Оба соединения используются в производстве различных материалов, например, при изготовлении проводов или покрытий на металлических изделиях для предотвращения коррозии.
Третий пример - соединение марганца (Mn) с азотом. Марганец может иметь степень окисления +2 или +7. При соединении с азотом образуются различные соединения, такие как MnN2 и Mn2N7. Эти соединения используются в производстве сплавов, катодов для аккумуляторов и других электрохимических устройств.
Все эти примеры демонстрируют, что металлы могут образовывать разнообразные соединения с различными степенями окисления, что позволяет расширить их применение в различных сферах науки и промышленности.
Роль степени окисления в химических реакциях

Степень окисления — это числовое значение, отражающее изменение электронного состояния атома в химическом соединении. Она играет важную роль в химических реакциях, поскольку определяет возможность происхождения окислительно-восстановительных процессов.
При химической реакции происходит перераспределение электронов между атомами, что приводит к изменению состояния их степеней окисления. Правильное определение степени окисления является основой для понимания механизмов реакций и прогнозирования их результатов.
Стихийное окисление или восстановление металлов зависит от их степени окисления. Например, металлы с более высокой степенью окисления обладают большей способностью отдавать электроны и восстанавливаться. Степень окисления также помогает определить, сколько электронов было передано между реагентами и продуктами реакции.
Окислительно-восстановительные реакции основаны на изменении степени окисления молекулы или атома, что позволяет электронам перемещаться между различными веществами. Степень окисления используется для балансировки химических уравнений и определения количества веществ, участвующих в реакции.
Знание степени окисления помогает химикам предсказать химическую активность вещества, его способность к окислению или восстановлению, а также изучать его электрохимические свойства. Таким образом, степень окисления играет важную роль в понимании механизмов химических реакций и помогает составить полную картину происходящих процессов.
Изменение степени окисления при взаимодействии металлов с другими веществами
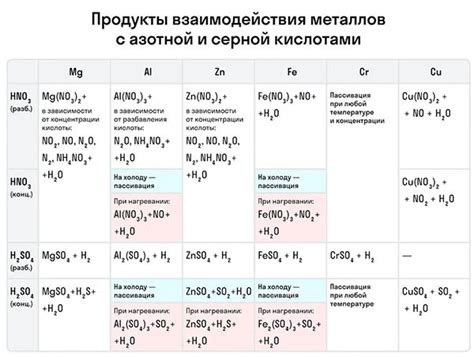
Взаимодействие металлов с другими веществами может привести к изменению степени окисления металла. Степень окисления характеризует электронную конфигурацию атома металла и может быть положительной или отрицательной величиной.
При взаимодействии металлов со веществами, которые могут принять электроны, металл может отдать свои электроны и окислиться. В этом случае степень окисления металла увеличивается. Например, при взаимодействии железа с кислородом образуется оксид железа, в котором железо имеет степень окисления +3.
Однако, при взаимодействии металлов со веществами, которые могут передать электроны металлу, металл может принять электроны и восстановиться. В этом случае степень окисления металла уменьшается. Например, медь может взаимодействовать с серной кислотой, при этом медь окисляется до иона меди(II) с положительным зарядом.
Меняется степень окисления металла при взаимодействии не только с кислородом или кислотами, но и с другими веществами, например солями, основаниями или комплексными соединениями. Изменение степени окисления металла играет важную роль в различных химических реакциях и может влиять на свойства и характеристики соединений.
Значение степеней окисления металлов в различных областях науки и промышленности

Степени окисления металлов играют важную роль в различных областях науки и промышленности. Они определяют химические свойства и возможности использования металлов в различных процессах.
В химии степень окисления металла указывает на число электронов, которые металл отдал или принял при образовании ионов в соединении. Например, в соединении Fe2O3 степень окисления железа равна +3, а в соединении MnO2 степень окисления марганца равна +4. Эти данные позволяют установить химическую реакцию, в которой металл участвует, и способствуют разработке новых соединений и материалов.
В биологии степень окисления металлов имеет особое значение. Многие металлы, такие как железо, магний и цинк, являются неотъемлемой частью биологических систем. Они участвуют в реакциях окислительно-восстановительного обмена и играют важную роль в жизненно важных процессах организмов, таких как фотосинтез, дыхание и иммунная защита.
В промышленности знание степеней окисления металлов позволяет определить особенности их взаимодействия с другими веществами и использовать их для получения необходимых продуктов и материалов. Например, сталь, которая представляет собой сплав железа и углерода, обладает высокой прочностью и прочими ценными свойствами благодаря наличию различных степеней окисления железа в составе сплава.
Таким образом, знание степеней окисления металлов необходимо в различных областях науки и промышленности для понимания и использования химических свойств и возможностей этих важных элементов.
Вопрос-ответ

Какие формулы соединений металлов используются в зависимости от степени окисления?
В зависимости от степени окисления металлов могут использоваться различные формулы соединений. Например, для металлов, имеющих положительные степени окисления, используются обычные формулы, например Fe2O3 для трехвалентного железа или CuO для двухвалентной меди. В случае отрицательных степеней окисления металлов, используются формулы с анионами, обозначающими степень окисления металла, например FeO2 для железа с валентностью -2 или MnO4 для марганца с валентностью +7.
Какие формулы соединений используются для металлов с положительной степенью окисления?
Для металлов с положительной степенью окисления используются обычные формулы соединений. Например, для двухвалентной меди используется формула CuO, для трехвалентного железа - Fe2O3, для четырехвалентного свинца - PbO2 и так далее. В этих формулах металл и кислород соединены обычными валентностью 2, 3 или 4 связями.
Какие формулы соединений применяются для металлов с отрицательной степенью окисления?
Для металлов с отрицательной степенью окисления применяются формулы соединений с анионами, обозначающими степень окисления металла. Например, для железа с валентностью -2 используется формула FeO2, для марганца с валентностью +7 - формула MnO4, для серебра с валентностью +1 - формула AgO и т.д. В этих формулах металл и кислород связаны через анионы, обозначающие степень окисления металла.
