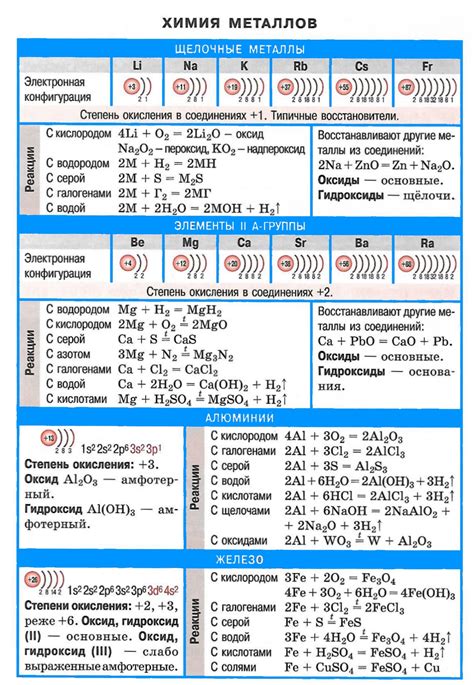
Щелочные металлы – это элементы первой группы периодической таблицы. Они характеризуются высокой химической активностью и реактивностью, что обусловлено наличием одной валентной электронной оболочки. Формулы соединений щелочных металлов представляют собой комбинации ионов металла и анионов, образующих образующиеся соединения.
Одно из самых простых соединений щелочных металлов – это гидроксиды, образуемые взаимодействием металла с гидроксидом. Например, натрий образует гидроксид натрия (NaOH), калий – гидроксид калия (KOH), а литий – гидроксид лития (LiOH).
Еще один тип соединений – это соли щелочных металлов. Важно отметить, что щелочные металлы образуют только одновалентные ионы, поэтому ионы, образующие соли, всегда имеют заряд -1. Например, хлорид натрия (NaCl), гидрофосфат калия (KH2PO4) и нитрат лития (LiNO3).
Также щелочные металлы образуют соединения с кислотами, образуя соль и воду. Например, сернокислый натрий (Na2SO4), сероводороднокислый калий (KHS) и сернокислый литий (Li2SO4).
Обзор щелочных металлов
Щелочные металлы – это первая группа периодической таблицы элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их химические свойства исследуются учеными уже много лет и они являются важными элементами в различных областях науки и технологий.
Одним из ключевых свойств щелочных металлов является их высокая реактивность. Они активно взаимодействуют с водой, кислородом и другими химическими элементами, образуя разнообразные соединения. Например, литий образует щелочные гидроксиды, которые используются в производстве мыла и других жидкостей для умывания.
Щелочные металлы также обладают высокой электропроводностью и используются в производстве батарей. Натрий широко применяется в пищевой промышленности для соления и консервации продуктов, а также в производстве стекла и металлургии. Калий является важным элементом для растений и используется в сельском хозяйстве в качестве удобрения.
Многие оксиды щелочных металлов обладают щелочными свойствами и используются в производстве стекла, керамики и электролитических процессов. Калий и его соединения также применяются в фармацевтической промышленности, в производстве лекарственных средств и косметических препаратов.
Щелочные металлы имеют широкий спектр применения и очень важны для многих отраслей промышленности. Благодаря их уникальным свойствам и химической активности, они играют важную роль в современной науке и технологиях.
Химические свойства щелочных металлов

Щелочные металлы - это элементы I группы периодической системы, включающие в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них похожая структура электронных оболочек, что определяет их схожие химические свойства.
Одним из основных свойств щелочных металлов является их реакционная способность. Они активно взаимодействуют с водой, кислородом и большинством неметаллов. При этом образуются гидроксиды, оксиды, соли и другие соединения.
Реакции щелочных металлов с водой достаточно интенсивные. Литий реагирует самым активным образом, при этом образуется гидроксид лития и выделяется водород. Остальные щелочные металлы также образуют гидроксиды и выделяются водород, но реакция проходит более медленно, по сравнению с литием.
Характерной особенностью щелочных металлов является их способность образовывать соли. Например, натрий, калий и другие щелочные металлы образуют хлориды, сульфаты, нитраты и другие соединения.
Щелочные металлы также обладают высокой электроотрицательностью, что отражается на их взаимодействии с кислородом. Они образуют оксиды, в которых щелочной металл находится в окисленном состоянии.
Химические свойства щелочных металлов широко используются в различных областях. Например, натрий используется для производства щелочей, стекла, алюминия и других веществ. Калий используется в сельском хозяйстве как удобрение, а рубидий применяется в радиоэлектронике и оптике.
Соединения щелочных металлов

Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они химически активны и легко образуют соединения с другими элементами. Их соединения широко используются в различных отраслях промышленности и научных исследованиях.
Одним из наиболее известных соединений щелочных металлов является гидроксид. Гидроксиды щелочных металлов образуются в результате реакции металла с водой. Например, литий образует литиевый гидроксид (LiOH), натрий – гидроксид натрия (NaOH), калий – гидроксид калия (KOH) и так далее. Гидроксиды щелочных металлов широко применяются в качестве щелочных растворов и мощных оснований, а также в производстве мыла и бумаги.
Другими распространенными соединениями щелочных металлов являются их соли. Соли щелочных металлов образуются в результате реакции металла с кислотой или другими кислотными соединениями. Например, хлорид натрия (NaCl) может быть получен путем реакции натрия с хлороводородной кислотой (HCl). Соли щелочных металлов используются в пищевой промышленности, в производстве стекла, керамики, металлургии и других областях.
Важными соединениями щелочных металлов являются также их оксиды. Оксиды щелочных металлов образуются в результате реакции металла с кислородом или другими оксидообразующими элементами. Например, оксид лития (Li2O) образуется при реакции лития с кислородом. Оксиды щелочных металлов используются в качестве катализаторов, в производстве стекла и керамики, а также в различных электронных устройствах.
Соединения щелочных металлов играют важную роль в нашей жизни и находят широкое применение в различных отраслях промышленности. Изучение их свойств и возможностей применения продолжается и вносит вклад в развитие науки и технологий.
Формулы бинарных соединений щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы и обладают характерными свойствами, такими как мягкость, низкая плотность и низкий плавящийся точка.
Бинарные соединения щелочных металлов образуются при реакции этих металлов с другими элементами. Обычно эти соединения имеют ионную структуру и образуют кристаллическую решетку. Формула таких соединений может быть записана в виде МХ, где М - щелочный металл, а Х - другой элемент.
Наиболее распространенным и известным бинарным соединением щелочных металлов является хлорид натрия (NaCl). Его формула соответствует соединению натрия с хлором, при этом оба элемента образуют ионы: ион натрия (Na+) и ион хлора (Cl-). Другим примером соединения щелочного металла является бромид калия (KBr), где калий (K+) образует положительный ион, а бром (Br-) - отрицательный ион.
Образование бинарных соединений щелочных металлов может происходить не только с элементами главной подгруппы, но и с элементами побочных подгрупп. Например, котонник является бинарным соединением калия и азота (K3N). Он образуется при реакции металла с азотом и имеет ионную структуру.
Соединения щелочных металлов имеют широкий спектр применений в различных отраслях науки и промышленности. Например, хлорид натрия используется в пищевой промышленности как пищевая добавка, а калия бромид используется в фотографии как реактив.
Формулы соединений с ионами щелочных металлов

Щелочные металлы включают в себя элементы I группы периодической системы - литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). В соединениях с другими элементами образуются ионы щелочных металлов, которые имеют положительный заряд.
Ионы лития имеют заряд +1 и обозначаются как Li+. Примерами соединений с ионами лития являются литийфосфат (Li3PO4), литийгидроксид (LiOH) и литиевый карбонат (Li2CO3).
Ионы натрия также имеют заряд +1 и обозначаются как Na+. Натрий может образовывать соединения с различными элементами. Некоторые из них включают натрий хлорид (NaCl), натрий оксид (Na2O) и натрий карбонат (Na2CO3).
Калий образует ионы с зарядом +1 (K+). Примерами соединений с ионами калия являются калий хлорид (KCl), калий перманганат (KMnO4) и калий нитрат (KNO3).
Ионы рубидия, обозначаемые как Rb+, также имеют заряд +1. Соединения с ионами рубидия включают рубидий бромид (RbBr), рубидий сульфат (Rb2SO4) и рубидий хлорид (RbCl).
Цезий образует ионы с зарядом +1 (Cs+). Некоторые соединения с ионами цезия включают цезий йодид (CsI), цезий сульфат (Cs2SO4) и цезий нитрат (CsNO3).
Формулы соединений с ионами щелочных металлов помогают определить состав и свойства этих соединений. Знание этих формул особенно полезно для проведения химических реакций и изучения свойств веществ.
Соединения щелочных металлов с названиями
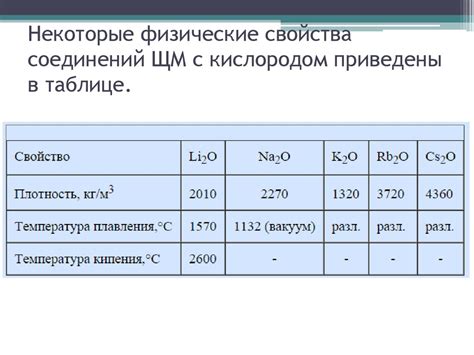
Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реактивностью и легко образуют соединения с другими элементами.
Важной характеристикой соединений щелочных металлов является наличие их названий, которые отражают состав и структуру этих соединений.
Назначение названий соединений щелочных металлов определяется правилами номенклатуры химических соединений. Обычно название соединения состоит из двух частей: названия металла и названия аниона. Например, соединение натрия и хлора имеет название хлорид натрия (NaCl), а соединение калия и кислорода - оксид калия (K2O).
В некоторых случаях, при образовании простых ионных соединений, названия анионов щелочных металлов могут немного отличаться от их названий в свободном состоянии. Так, анион лития обычно называется "литид", а анион калия - "калид".
Существуют также соединения, в которых щелочные металлы образуют более сложные структуры, например, карбиды, нитриды, гидриды и другие. Названия таких соединений могут быть более специфичными и содержать дополнительные суффиксы, указывающие на состав и структуру соединений.
Изучение соединений щелочных металлов с названиями позволяет лучше понять их физико-химические свойства и использовать их в различных областях науки и техники, включая медицину, электронику, катализ и энергетику.
Примеры соединений щелочных металлов с названиями

Щелочные металлы - это первая группа элементов периодической системы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются высокой реактивностью и имеют сходные химические свойства.
Одним из первых примеров соединений щелочных металлов является хлорид лития (LiCl). Он представляет собой белый кристаллический порошок, растворимый в воде. Хлорид лития используется в производстве литиевых аккумуляторов, а также в фармацевтической и химической промышленности.
Другим примером соединения щелочных металлов является гидроксид натрия (NaOH), также известный как едкая сода или натреонат. Это белые кристаллы, растворимые в воде с выделением большого количества тепла. Гидроксид натрия широко используется в промышленности как щелочное вещество и катализатор в химических реакциях.
Карбонат калия (K2CO3) - еще один пример соединения щелочных металлов. Это белые кристаллы, растворимые в воде. Карбонат калия используется в стекольной и мыльной промышленности, а также в химических процессах производства щелочей.
Рубидий цианид (RbCN) - это соль рубидия и цианидной кислоты. Он представляет собой белый кристаллический порошок, растворимый в воде. Рубидий цианид используется в электролитических процессах, а также в производстве некоторых лекарственных препаратов.
Цезий азид (CsN3) - это соль цезия и азидной кислоты. Это белый кристаллический порошок, растворимый в воде. Цезий азид используется в пиротехнике и синтезе других химических соединений.
Вопрос-ответ

