Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и реагируют с кислотами, образуя соли и выделяя водород. Реакция щелочных металлов с кислотами основана на процессе обмена ионами, где положительно заряженные ионы металла замещают положительно заряженные ионы водорода в кислоте. Это приводит к образованию солей, которые являются основными и солевыми соединениями.
Формула реакции между щелочным металлом и кислотой имеет вид:
М + HA → MA + H2
Где M обозначает щелочной металл, HA - кислота, MA - соль щелочного металла, H2 - молекулярный водород.
Особенностью реакции щелочных металлов с кислотами является высокая скорость процесса и интенсивное выделение водорода. Щелочные металлы имеют низкую электроотрицательность, что делает их очень реактивными. Реакция идет с высвобождением большого количества энергии и может сопровождаться плавящимся кислотным раствором и образованием пены. Поэтому реакции щелочных металлов с кислотами требуют аккуратного и осторожного обращения, так как могут привести к опасным последствиям.
Определение щелочных металлов и их реакции
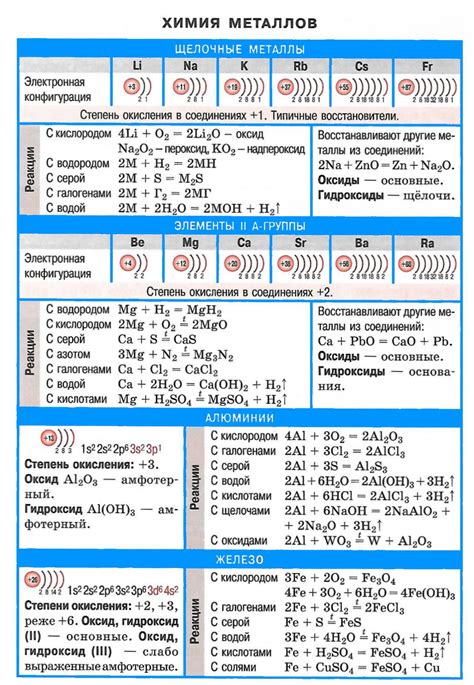
Щелочные металлы — это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой реактивностью, низкой плотностью и низкой температурой плавления.
Реакция щелочных металлов с кислотами основана на образовании соли и выделении водорода. Щелочные металлы обладают высокой активностью, поэтому они способны вытеснять водород из кислоты. Эта реакция является экзотермической и сопровождается выделением тепла и плавления металла.
В процессе реакции можно наблюдать характерные признаки: пузырьки газа, искры, тепло и изменение цвета раствора. Например, реакция натрия с соляной кислотой образует соль натрия и выделяет водород. Раствор при этом приобретает яркую желтую окраску, что является характерным признаком образования хлорида натрия.
Таблица 1. Примеры реакций щелочных металлов с кислотами:
| Щелочный металл | Кислота | Соль | Образующийся газ |
|---|---|---|---|
| Натрий (Na) | Хлорная кислота (HCl) | Хлорид натрия (NaCl) | Водород (H2) |
| Калий (K) | Серная кислота (H2SO4) | Сульфат калия (K2SO4) | Водород (H2) |
| Литий (Li) | Фосфорная кислота (H3PO4) | Фосфат лития (Li3PO4) | Водород (H2) |
Реакции щелочных металлов с кислотами являются важными в химической промышленности и используются, например, для получения солей, водорода и других продуктов.
Описание кислот и их реакций с щелочными металлами

Кислоты - это вещества, которые при взаимодействии с водой образуют ионные растворы, содержащие положительный ион водорода (H+). Они являются одним из важнейших классов химических соединений и имеют широкий спектр применений в различных областях науки и промышленности.
Щелочные металлы - это элементы периодической системы, которые характеризуются наличием одного электрона в своей внешней оболочке. Они обладают высокой реакционной способностью и активно взаимодействуют с кислотами, образуя соли и выделяя молекулы водорода.
Реакция между кислотой и щелочным металлом протекает по следующей схеме: щелочной металл + кислота → соль + водород. Например, при взаимодействии натрия (Na) с соляной кислотой (HCl) образуется хлорид натрия (NaCl) и выделяется молекула водорода (H2).
Одной из особенностей реакций щелочных металлов с кислотами является энергичность их протекания. Такие реакции сопровождаются выделением большого количества тепла и образованием пенящегося газа - водорода. Кроме того, реакция может протекать достаточно быстро и взрывоопасно, особенно в случае использования концентрированных кислот.
При реакции между щелочными металлами и кислотами образуется соль - ионное соединение, состоящее из положительного иона металла и отрицательного иона кислоты. Соли, полученные в результате таких реакций, обладают различными свойствами и применяются в различных отраслях промышленности и науки.
Применение реакций щелочных металлов с кислотами в научных и технических областях

Реакции щелочных металлов с кислотами имеют широкое применение в научных и технических областях. Одним из примеров такого применения является использование этих реакций для получения нужных соединений. Щелочные металлы, такие как натрий, калий и литий, реагируют с различными кислотами, образуя соли и выделяя молекулы воды. Этот процесс может быть использован для получения чистых продуктов исследований и производства различных веществ.
В области фармацевтики и медицины, реакции щелочных металлов с кислотами используются для получения лекарственных солей. Эти соли обладают определенными свойствами, которые позволяют осуществлять доставку активных веществ в организм. Такие реакции играют важную роль в разработке новых лекарственных препаратов и их производстве.
В технических областях, реакции щелочных металлов с кислотами часто используются в процессах очистки и обработки различных материалов. Например, реакция натрия с кислотой может использоваться для удаления оксидов и примесей с поверхности металлических изделий. Также эти реакции могут быть применены в процессах получения определенных материалов и соединений, которые используются в различных отраслях промышленности.
Благодаря своей высокой реакционной способности и возможности образования различных солей, реакции щелочных металлов с кислотами находят применение не только в лабораторных условиях, но и в промышленности и научных исследованиях. Они предоставляют уникальные возможности для получения чистых и целевых продуктов, а также для обработки и очистки различных материалов и изделий.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие кислоты могут реагировать с щелочными металлами?
Щелочные металлы реагируют с кислотами, такими как соляная кислота (HCl), серная кислота (H2SO4) и много других. Однако не реагируют сильные окислители, такие как концентрированный азотная кислота (HNO3).
В чем особенность реакции щелочных металлов с кислотами?
Особенностью реакции щелочных металлов с кислотами является выделение водорода (H2), который может зажигаться в присутствии огня. Кроме того, в результате реакции образуется соответствующая соль и вода.
