Оксиды являются соединениями, в которых металл соединяется с кислородом. Одним из таких соединений является оксид металла Cl2O7. Этот оксид образуется при реакции хлорной кислоты с хлоратом натрия. Формула Cl2O7 означает, что в молекуле оксида металла содержится два атома хлора и семь атомов кислорода. Такая формула помогает определить состав и строение оксида, а также его свойства.
Создание Cl2O7 свидетельствует о высокой активности и реакционной способности этого соединения. Оксид металла Cl2O7 является кислым оксидом, что означает его способность реагировать с водой, образуя кислоту. В свою очередь, это даёт возможность использовать Cl2O7 в качестве окислителя в различных химических реакциях.
Свойства оксида металла Cl2O7 также включают его высокую термическую стабильность и низкую температуру кипения. Более того, оксид Cl2O7 обладает сильной окислительной активностью, что позволяет ему взаимодействовать с различными веществами, в том числе органическими соединениями. Это свойство делает Cl2O7 полезным элементом в процессе синтеза различных органических соединений.
Контролируемое использование оксида металла Cl2O7 имеет большое практическое значение в различных отраслях науки и промышленности. Благодаря его свойствам, Cl2O7 может использоваться в процессе синтеза кислот, в производстве лекарственных препаратов и в качестве реагента в химической аналитике. Для достижения наилучших результатов и безопасного использования Cl2O7 необходимо тщательно контролировать условия его хранения и использования.
Формулы оксидов металлов Cl2O7

Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Одним из таких соединений является оксид Cl2O7, в котором металлом выступает хлор (Cl).
Формула оксида Cl2O7 указывает на то, что в данном соединении два атома хлора (Cl) связаны с семью атомами кислорода (O). Таким образом, в молекуле Cl2O7 присутствуют две группы клора и семь групп кислорода.
Данный оксид является кислотным, так как хлор имеет положительный окислительный центр и способен отдавать протоны. Также оксид Cl2O7 относится к хлорным оксидам, которые обладают высокой степенью окислительности и взаимодействуют с водой, образуя кислоты.
Оксид Cl2O7 обладает сильными окислительными свойствами и может реагировать с органическими и неорганическими веществами. Он также может вызывать воспаление и коррозию металлов, поэтому должен храниться и использоваться с осторожностью.
Состав

Оксид металла Cl2O7 образуется при соединении молекулы хлора с молекулой кислорода. Его химическая формула указывает на наличие двух атомов хлора и семи атомов кислорода. Таким образом, оксид Cl2O7 состоит из 2 атомов хлора и 7 атомов кислорода.
Молекула Cl2O7 имеет структуру, состоящую из двух атомов хлора, соединенных с семью атомами кислорода в форме кольца. В обычных условиях эта молекула является газообразной и обладает сильными окислительными свойствами.
Соединение Cl2O7 также можно представить в виде ионной формулы, где два атома хлора образуют ион Cl+, а семь атомов кислорода образуют ион O2-. Такая ионная формула отражает наличие положительного и отрицательного заряда в молекуле оксида металла Cl2O7.
Состав оксидов металлов тесно связан с их химическими свойствами и реакционной способностью. Оксид Cl2O7 является одним из самых реакционноспособных оксидов, так как оно обладает высокой степенью окислительности, что позволяет ему взаимодействовать с различными веществами и вызывать реакции окисления.
Свойства
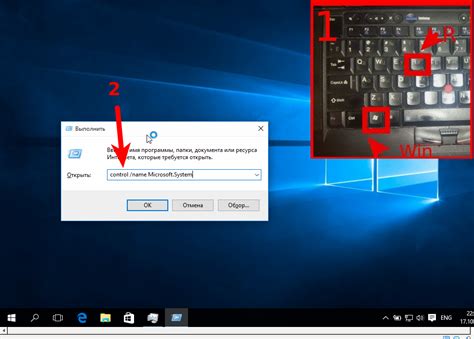
Оксиды металлов Cl2O7 обладают рядом характерных свойств:
- Реактивность: оксиды металлов Cl2O7 являются очень реакционными веществами. Они обладают сильными окислительными свойствами и могут взаимодействовать с различными веществами;
- Кислотность: оксиды металлов Cl2O7 являются оксидами, которые образуют кислоты при реакции с водой. Кислотность оксидов возрастает с увеличением рн металла;
- Вещества, представленные оксидами металлов Cl2O7, обычно имеют высокую температуру плавления и кипения. Благодаря этому, они могут использоваться как теплоносители в различных процессах, например, в химических реакторах;
- Растворимость: оксиды металлов Cl2O7 умеренно растворимы в воде. При растворении они образуют кислотные растворы, что характерно для оксидов металлов с высокой степенью окисления;
- Структура: оксиды металлов Cl2O7 обычно обладают сложной структурой. Они могут формировать кристаллические решетки с разными типами связей между атомами.
Вопрос-ответ

Какой состав имеет оксид металла Cl2O7?
Оксид металла Cl2O7 имеет следующий состав: 2 молекулы хлора (Cl) и 7 молекул кислорода (O).
Каковы свойства оксида металла Cl2O7?
Оксид металла Cl2O7 является сильным окислителем и очень реактивным веществом. Он обладает высокой степенью окисления и может вызывать серьезные ожоги при контакте с кожей. Он также способен выделять ядовитые газы при реакции с водой.
В каких процессах может использоваться оксид металла Cl2O7?
Оксид металла Cl2O7 может использоваться в процессах химического синтеза, органическом синтезе и в производстве определенных химических соединений, таких как кислотные галогениды. Он также может быть использован в качестве окислителя или катализатора в некоторых химических реакциях.
Какие есть альтернативные названия для оксида металла Cl2O7?
Оксид металла Cl2O7 также называется дихлоргептоксидом, гептоксидом хлора или хлоровым ангидридом.
