Соляная кислота, также известная как хлороводородная кислота, является одной из наиболее распространенных и важных неорганических кислот. Ее формула HCl указывает на наличие одной молекулы хлора и одной молекулы водорода в каждой молекуле кислоты. Благодаря своей сильной кислотности, соляная кислота обладает высокой реакционной способностью и может проявлять химические взаимодействия с различными веществами, включая металлы.
Реакции металлов с соляной кислотой основаны на способности кислоты отдавать протоны (водородные ионы H+). Металлы, в свою очередь, обладают способностью принимать эти протоны, что приводит к образованию водорода (H2) и солей металлов. В результате химической реакции между металлами и соляной кислотой образуются металлические соли, которые могут иметь различные свойства и применение в разных областях науки и технологии.
Например, реакция металла цинка (Zn) с соляной кислотой приводит к образованию цинка хлорида (ZnCl2) и выделению молекул водорода:
Zn + 2HCl → ZnCl2 + H2
Подобным образом можно рассмотреть и другие реакции металлов, таких как железа (Fe), меди (Cu), алюминия (Al) и многих других. Каждая реакция будет иметь свою уникальную химическую формулу и специфические характеристики. Знание этих реакций является важным для понимания взаимодействия металлов с окружающей средой, а также для применения в промышленности и научных исследованиях.
Что такое неорганическая реакция металлов?
Неорганическая реакция металлов - это процесс взаимодействия металлов с различными химическими веществами, такими как кислоты, щелочи, соли и газы. Эти реакции основаны на том, что металлы имеют способность образовывать ионные соединения, а также обладают электрохимическими свойствами.
Одной из самых распространенных неорганических реакций металлов является их взаимодействие с соляной кислотой (HCl). Во время этой реакции металл участвует в окислительно-восстановительной реакции, при которой происходит образование соли и выделение водорода.
Реакция металла с соляной кислотой может быть представлена следующей химической формулой: металл + соляная кислота → соль + водород. На примере реакции цинка (Zn) с HCl реакционное уравнение будет выглядеть так: Zn + 2HCl → ZnCl2 + H2.
В результате реакции возникает ионный соединение металла с анционом кислоты, которое в данном случае представлено хлоридом цинка (ZnCl2). Водород (H2), который выделяется при реакции, является газом и может быть обнаружен наблюдением по возникновению пузырьков вещества.
Взаимодействие металлов с кислотами является важным в химической промышленности, в лабораторных условиях и для понимания основных принципов реакций. Такие реакции позволяют установить активность металлов, их способность реагировать с различными веществами и применение в разных отраслях науки и промышленности.
Роль металлов в химических реакциях

Металлы играют важную роль в химических реакциях благодаря своим свойствам и химическим характеристикам. Они являются активными элементами, способными взаимодействовать с другими веществами и образовывать различные соединения.
Когда металлы вступают в реакцию с кислотами, такими как соляная кислота (HCl), происходит образование новых соединений. Например, при взаимодействии железа (Fe) с соляной кислотой образуется хлорид железа (FeCl2) и водород (H2).
При этом происходят химические процессы: металл вытесняет водород из кислоты и образует хлорид металла. Взаимодействие происходит из-за разности активностей элементов и их электрохимического потенциала.
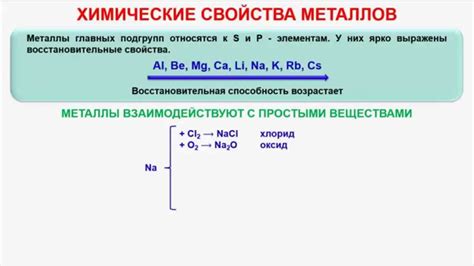
Металлы могут быть активными или пассивными в зависимости от их реакционной способности. Некоторые металлы, такие как калий (K) и натрий (Na), являются очень активными и способны реагировать с различными компонентами, включая кислоты. В то же время, некоторые металлы, например, золото (Au) и платина (Pt), являются пассивными и не проявляют реакционной активности.
Таким образом, металлы играют важную роль в химических реакциях, способствуя образованию новых соединений и приводя к изменению свойств и состояний веществ. Изучение реакций металлов помогает понять основные законы и принципы химии и имеет практическое значение в промышленности и научных исследованиях.
Металлы в неорганической химии

Металлы занимают важное место в неорганической химии и являются основными строительными блоками всех материалов. Металлы обладают характерными свойствами, такими как отличная теплопроводность, электропроводность и гибкость. Они образуют растворы с различными кислотами и основаниями, что делает их прекрасными реагентами для химических превращений.
При взаимодействии металлов с соляной кислотой происходит химическая реакция, в результате которой образуется соль и выделяется водород. Формула реакции может быть представлена следующим образом: Металл + Соляная кислота → Соль + Водород.
При этой реакции металл отдает свои электроны, превращаясь в положительно заряженные ионы. В свою очередь, водородные ионы соляной кислоты присоединяются к свободным электронам металла, образуя молекулы водорода. Это пример классической односторонней реакции, в которой металл служит донором электронов, а соляная кислота - ацептором.
Реакция металлов с соляной кислотой может использоваться в различных областях, например, для создания взрывчатых веществ или в промышленности при производстве металлов. Также они используются в препаративной химии для синтеза органических соединений или в химическом анализе для выделения и определения определенных металлов.
Соляная кислота: формула и свойства

Соляная кислота – одна из самых распространенных и важных химических соединений, которая широко применяется в промышленности и научных исследованиях. Ее формула – HCl, где H обозначает атом водорода, а Cl – атом хлора. Молекулы соляной кислоты состоят из одного атома водорода и одного атома хлора, связанных между собой координационной химической связью.
Соляная кислота обладает рядом важных свойств, среди которых можно выделить ее кислотность, ярко выраженную коррозионную активность и хорошую растворимость в воде. Эти свойства делают соляную кислоту полезным и необходимым химическим веществом во многих областях.
Одно из основных свойств соляной кислоты – ее кислотность. Когда она растворяется в воде, она образует водородные и хлоридные ионы, которые вносят вклад в кислотные реакции. Благодаря этим ионам соляная кислота проявляет химическую реактивность и способна реагировать с многими веществами.
У соляной кислоты также есть сильная коррозионная активность. Она может разрушать многие материалы, включая металлы. При взаимодействии с металлами, такими как железо или алюминий, соляная кислота вызывает реакцию, при которой образуются соответствующие соли и выделяется газ – водород. Эта реакция широко используется в промышленности и лабораториях для получения водорода.
Что такое соляная кислота?
Соляная кислота – это одна из самых распространенных и важных неорганических кислот. Ее химическая формула HCl указывает на ее состав из водорода и хлора.
Соляная кислота обладает рядом характерных свойств, которые делают ее полезной в различных областях. Она является сильной кислотой с пониженным pH, что обуславливает ее химическую активность и способность реагировать с множеством веществ.
Соляная кислота обычно находится в жидком виде и имеет острый, едкий запах. В коммерческом виде она продаётся в разбавленном виде под названием «соляная кислота техническая» со сниженной концентрацией. Кроме того, она является ключевым компонентом раствора, который называется «соляная кислота домашнего использования» и часто используется для очистки различных поверхностей.
Соляная кислота также широко применяется в химической промышленности для синтеза органических и неорганических соединений, а также в лабораторном исследовании для проведения различных химических реакций и анализов.
Формула соляной кислоты

Соляная кислота (HCl) – это бесцветная жидкость с характерным запахом, состоящая из водорода и хлора. В химической формуле соляной кислоты, H обозначает атом водорода, а Cl - атом хлора. Таким образом, формула соляной кислоты выглядит как HCl.
В молекуле соляной кислоты атомы водорода и хлора связаны ковалентной химической связью. Кислород не содержится в формуле соляной кислоты, так как она не является кислородсодержащей кислотой.
Соляная кислота является одной из самых распространенных и важных кислот в химии. Она обладает сильными кислотными свойствами и реагирует с многими веществами, в том числе с металлами.
Знание формулы соляной кислоты является важным для понимания ее химических свойств и реакций с другими веществами.
Реакция металлов с соляной кислотой

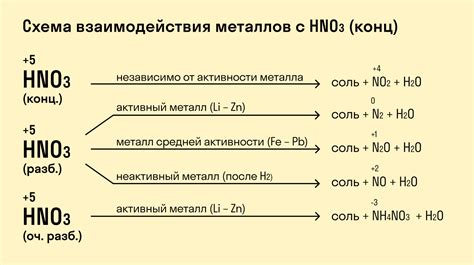
Реакция металлов с соляной кислотой представляет собой химическую реакцию, при которой металл реагирует с соляной кислотой и образует соль и водород. Такая реакция является типичной для большинства активных металлов, таких как цинк, железо, медь и алюминий.
Во время реакции металл активно взаимодействует с соляной кислотой, отдавая свои электроны. При этом происходит окисление металла и восстановление протонов из соляной кислоты, что приводит к образованию ионов металла и водорода. Полученный водород образует пузырьки, которые можно наблюдать во время реакции.
Соляная кислота, или хлороводородная кислота (HCl), является одной из самых распространенных кислот. Ее формула состоит из молекулы водорода и молекулы хлора. При взаимодействии с металлами, соляная кислота отдает свои протоны и образует соль металла и воду.
Реакция металлов с соляной кислотой можно представить в виде химического уравнения. Например, реакция железа (Fe) с соляной кислотой (HCl) приводит к образованию хлорида железа (FeCl2) и водорода (H2).
| Металл | Соляная кислота | Соль | Водород |
|---|---|---|---|
| Цинк (Zn) | 2HCl | ZnCl2 | H2 |
| Железо (Fe) | 2HCl | FeCl2 | H2 |
| Медь (Cu) | 2HCl | CuCl2 | H2 |
Этот тип реакции используется в химической промышленности для получения различных металлических соединений. Кроме того, реакция металлов с соляной кислотой также является основой для определения присутствия металлов и их концентрации в различных образцах в лаборатории.
Химическое взаимодействие металлов и кислоты
Металлы могут реагировать с кислотами, образуя соли и выделяя при этом водород. Химическая реакция происходит между активным металлом и кислотой, где металл действует как окислитель, а кислота - как восстановитель.
При взаимодействии металла с кислотой, в солевом соединении анодный и катодный потоки перемещаются в разные стороны, образуя электрический ток. Этот процесс называется электролизом и является важной характеристикой взаимодействия металла с кислотой.
Во время реакции соляной кислоты с металлами образуются соли хлориды, причем количество образующейся соли зависит от активности металла. Например, алюминий образует хлорид алюминия, медь - хлорид меди, а цинк - хлорид цинка.
Химическое взаимодействие металлов и кислоты может использоваться в различных промышленных и научных процессах. Например, при получении железа из руды используется реакция железа с соляной кислотой. Также, взаимодействие металлов и кислоты может быть полезным в процессах очистки воды и производства энергии.
Как проходит реакция?

Реакция металлов с соляной кислотой осуществляется в результате химического взаимодействия между металлом и кислотой. Во время реакции происходит обмен ионами между частицами металла и соляной кислоты.
В начале реакции, соляная кислота диссоциирует на ионы водорода (H+) и хлорида (Cl-). Ионы водорода действуют на поверхность металла, образуя водородные ионы (H+). Это вызывает активацию металла и его растворение в кислоте.
Реакция соляной кислоты с металлом протекает по типу односторонней реакции, так как только металл растворяется, а соляная кислота остается неизменной. При этом образуется соль металла и водородный газ.
Процесс растворения металла в соляной кислоте можно представить в виде химического уравнения:
Металл + соляная кислота → соль металла + водородный газ
Например, реакция цинка (Zn) с соляной кислотой (HCl) приводит к образованию хлорида цинка (ZnCl2) и выделению молекул водорода (H2).
Реакция металлов с соляной кислотой может протекать при обычной комнатной температуре и быстро протекать при нагревании. Избегайте проведения реакции в закрытом пространстве, так как выделяющийся водород может быть взрывоопасным.
Окисление металлов в реакции

Окисление металлов является одним из основных химических процессов, которые происходят при их взаимодействии с соляной кислотой. Во время реакции происходит передача электронов от металла к водороду, приводящая к образованию соли металла и выделению водорода.
Окисление происходит по следующей реакции: металл + соляная кислота → соль металла + водород. Важно отметить, что процесс окисления зависит от степени активности металла и концентрации соляной кислоты. Например, реакция цинка с разбавленной соляной кислотой протекает очень активно, при этом выделяется большое количество водорода.
При окислении металлов в реакции также происходит образование воды в результате соединения водорода, выделенного в процессе, с кислородом. Это можно представить следующим образом: 2H₂(g) + O₂(g) → 2H₂O(l).
Окисление металлов в реакции с соляной кислотой является важным процессом в промышленности и лабораторной практике, поскольку позволяет не только получать соли металлов, но и выделять водород, который может быть использован в различных технологических процессах.
Вопрос-ответ

Какие металлы реагируют с соляной кислотой?
Соляная кислота реагирует с большинством металлов, включая металлы активной группы (например, натрий, калий, магний), но не реагирует с металлами пассивной группы (например, серебро, платина).
Что происходит при реакции металлов с соляной кислотой?
При реакции металлов с соляной кислотой образуются соли и высвобождается водород. Например, реакция железа с соляной кислотой выглядит следующим образом: Fe + 2HCl = FeCl2 + H2.
Каким образом можно предсказать, будет ли металл реагировать с соляной кислотой?
Предсказать, будет ли металл реагировать с соляной кислотой, можно с помощью ряда напряжений. Если металл находится выше в ряду, то он реагирует с кислотой, если ниже, то нет. Например, металлы натрия и калия находятся выше в ряду и реагируют с соляной кислотой, а металлы меди и серебра находятся ниже и не реагируют.
Какова роль соляной кислоты в реакции с металлами?
Соляная кислота играет роль окислителя в реакции с металлами. Она окисляет металлы, отдавая им свои протоны и образуя соли. Кислота получает электроны от металла и превращается в воду или водород газ.





