Валентные подуровни металлического атома составляют основу для его химических свойств и взаимодействий с другими атомами. Однако, чтобы разобраться в структуре валентных подуровней, необходимо понять, что они представляют собой.
Структура валентных подуровней металлического атома представляет собой последовательность электронных орбиталей, в которых располагаются электроны. В данном случае, электроны размещены в подуровнях 1s, 4s и 4p. Каждый подуровень имеет свою энергию и форму орбитали, что определяет возможность взаимодействия электронов с другими атомами.
Подуровень 1s является наиболее близким к ядру атома и может содержать максимум 2 электрона. Подуровень 4s располагается на следующем уровне энергии и также может содержать максимум 2 электрона. Подуровень 4p находится на том же энергетическом уровне, что и 4s, и может содержать максимум 6 электронов.
Таким образом, суммарное количество электронов в валентных подуровнях металлического атома равно 2 + 2 + 6 = 10. Эти электроны являются валентными электронами, то есть электронами, участвующими в химических связях и реакциях.
Структура валентных подуровней металлического атома имеет ключевое значение для определения его химических свойств. Количество и положение валентных электронов определяют некоторые основные свойства, такие как реактивность, склонность к образованию ионов и возможность образования химических связей. Поэтому, понимание структуры валентных подуровней металлического атома является важным в науке об элементах и химии в целом.
Структура валентных подуровней
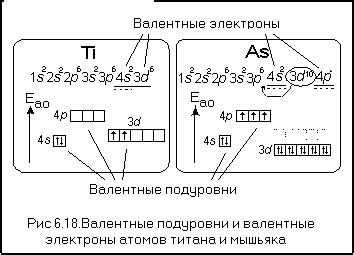
Валентные подуровни металлического атома определяют его химические свойства и возможность вступать в реакции с другими элементами. В данном случае рассматривается структура валентных подуровней металлического атома с электронной конфигурацией 1s^2 4s^2 4p^4.
Электронные конфигурации указывают на наличие электронов в различных энергетических уровнях и подуровнях атома. В данной электронной конфигурации металлического атома один электрон находится в субуровне s, а шесть электронов в подуровне p. Валентные электроны - это электроны, находящиеся на наиболее высоком энергетическом уровне и влияющие на химические свойства атома.
В данном случае, валентные подуровни металлического атома являются 4s и 4p. Их совокупность составляет собственно валентную оболочку атома, которая определяет его химическую активность. Наличие 2 электронов в подуровне 4s и 4 электронов в подуровне 4p позволяет металлическому атому образовывать химические связи.
Такая структура валентных подуровней обусловливает возможность металлического атома вступать в реакции с другими элементами, а также формировать ионы с различной валентностью. Однако, для полного понимания химических свойств металлического атома необходимо также учитывать другие факторы, такие как размер и заряд ядра, а также взаимодействие с окружающими атомами.
Структура валентных подуровней металлического атома: s^2
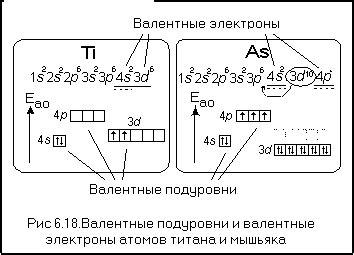
Металлический атом является активным химическим элементом, который обладает различными валентными подуровнями. В контексте данной темы структура валентных подуровней металлического атома описывается как s^2.
Подуровень s^2 представляет собой электронную оболочку, в которой находятся два электрона, заполнивших s-подуровень. Валентные электроны, расположенные на s-подуровне, влияют на химические свойства атома и его способность образовывать химические связи с другими атомами.
Валентные электроны, расположенные на s-подуровне металлического атома, обладают высокой реактивностью и способностью к образованию ионов. Они могут участвовать в химических реакциях, образуя связи с другими атомами и образуя химические соединения.
Структура валентных подуровней металлического атома с s^2 обычно связана с его положением в периодической системе элементов. Например, металлы группы 2 (как, например, магний) имеют структуру валентных подуровней 1s^2 2s^2, где s^2 отвечает за внутренний s-подуровень, содержащий два электрона.
В целом, структура валентных подуровней металлического атома с s^2 играет важную роль в химических реакциях и свойствах металлов, определяя их химическую активность и способность к образованию связей с другими элементами.
Структура валентных подуровней металлического атома: 1s^2 4s^2 4p^4
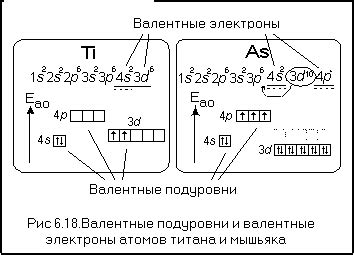
Валентные подуровни металлического атома описывают количество электронов, находящихся на последнем (внешнем) энергетическом уровне. В данном случае структура валентных подуровней металлического атома представлена в виде: 1s^2 4s^2 4p^4. Это означает, что на первом энергетическом уровне находятся 2 электрона, на втором энергетическом уровне - 2 электрона на s-подуровне и 4 электрона на p-подуровне.
Валентные электроны играют ключевую роль в химических реакциях и определяют химические свойства атома. В данном случае, металлический атом имеет 4 валентных электрона. Это означает, что атом будет обладать химической активностью, которая определяется его способностью образовывать химические связи с другими атомами.
Такая структура валентных подуровней металлического атома указывает на его расположение в периодической таблице элементов. В данном случае, атом принадлежит к 4 периоду и размещается в седьмой группе. Это означает, что атом имеет 4 энергетических уровня и 7 валентных электронов.
Таким образом, структура валентных подуровней металлического атома 1s^2 4s^2 4p^4 дает полную информацию о количестве электронов на внешнем энергетическом уровне и способности атома образовывать химические связи. Эта информация играет важную роль в понимании химических свойств и реакций металлических атомов.
Структура валентных подуровней металлического атома: 1s^2 4s^2 4p^4

Подуровень 4p^4 обозначает электронную конфигурацию валентной оболочки атома, где p означает орбиталь с моментом импульса равным 1. Этот подуровень содержит 4 электрона, что означает, что атом может образовывать связи с другими атомами через эти электроны.
Валентные электроны на подуровне 4p^4 имеют четыре возможные ориентации в пространстве, обозначающиеся как 4p_x, 4p_y, 4p_z и 4p_p. Каждая ориентация может содержать по два электрона в соответствии со спинами электронов - "вверх" и "вниз". Таким образом, общее число электронов на подуровне 4p^4 равно 4.
Валентные электроны на подуровне 4p^4 играют важную роль в химических реакциях и связывании атомов. Они могут образовывать ковалентные связи с другими атомами путем обмена электронами. Сочетая свои электроны с электронами других атомов, атом с подуровнем 4p^4 может достигать стабильной конфигурации, например, заполнив следующий подуровень 4p или 4d.
Подуровень 4p^4 может быть представлен в виде таблицы, где каждая ориентация описана в отдельной строке, а электроны для каждой ориентации указаны в ячейках таблицы. Например:
| Ориентация | Электроны |
|---|---|
| 4p_x | ↑ ↓ |
| 4p_y | ↑ ↓ |
| 4p_z | ↑ ↓ |
| 4p_p | ↑ ↓ |
Здесь символы ↑ и ↓ обозначают спины электронов, где ↑ означает электрон со спином "вверх", а ↓ - электрон со спином "вниз".
Структура валентных подуровней металлического атома: 1s^2 4s^2 4p^4

Металлическим атомом называется атом химического элемента, который обладает металлическими свойствами. В структуре валентных подуровней металлического атома указано распределение электронов по энергетическим уровням и орбиталям.
1s^2 - это означает, что на первом энергетическом уровне находится 2 электрона, которые расположены на s-орбитали.
4s^2 - указывает на наличие 2 электронов на четвертом энергетическом уровне на s-орбитали.
4p^4 - говорит о наличии 4 электронов на четвертом энергетическом уровне на p-орбиталях.
Таким образом, валентными электронами металлического атома являются 6 электронов, которые находятся на самых высоких энергетических уровнях. Они оказывают наибольшее влияние на химические свойства элемента и его способность к образованию химических связей.
Структура валентных подуровней металлического атома имеет большое значение для понимания его свойств и возможности взаимодействия с другими элементами в химических реакциях.
Структура валентных подуровней

Структура валентных подуровней металлического атома в данном случае представлена следующим образом: 1s^2 4s^2 4p^4. Это означает, что у атома на первом энергетическом уровне (n=1) находится два электрона, на четвертом энергетическом уровне (n=4) находятся два электрона в подуровне s и четыре электрона в подуровне p.
Подуровень s имеет форму шара и может содержать максимум два электрона. Подуровень p имеет форму груши и также может содержать максимум два электрона. Таким образом, валентные подуровни металлического атома образуют две пары электронов в подуровне s и одну пару электронов в подуровне p.
Валентные электроны - это электроны, находящиеся на самом высоком энергетическом уровне и внешних подуровнях атома. Именно они определяют химические свойства атома и его способность образовывать химические связи с другими атомами.
В данном случае, валентными электронами металлического атома являются электроны в подуровне s и p на четвертом энергетическом уровне. Общее число валентных электронов равно шести. Их наличие позволяет металлическому атому образовывать соединения и проявлять свои химические свойства при взаимодействии с другими элементами.
Таким образом, структура валентных подуровней металлического атома 1s^2 4s^2 4p^4 описывает наличие шести валентных электронов и их распределение по подуровням s и p на четвертом энергетическом уровне.
Вопрос-ответ

Какова общая структура валентных подуровней металлического атома?
Общая структура валентных подуровней металлического атома представляется в виде электронной конфигурации, которая показывает количество электронов в каждом энергетическом уровне и подуровне атома. В данном случае, у металлического атома электронная конфигурация выглядит следующим образом: 1s^2 4s^2 4p^4. Это означает, что у атома имеется 2 электрона в 1s подуровне, 2 электрона в 4s подуровне и 4 электрона в 4p подуровне.
Сколько электронов находится в первом энергетическом уровне металлического атома?
В первом энергетическом уровне металлического атома находится 2 электрона.
Какие подуровни заполнены электронами в этой структуре?
В этой структуре 1s и 4s подуровни заполнены электронами, а 4p подуровень заполнен частично, всего 4 электрона.
Какова общая сумма электронов во всех подуровнях валентной оболочки?
Общая сумма электронов во всех подуровнях валентной оболочки металлического атома равна 8. Это объясняется тем, что в 1s подуровне находятся 2 электрона, в 4s подуровне - также 2 электрона, и в 4p подуровне - 4 электрона.
