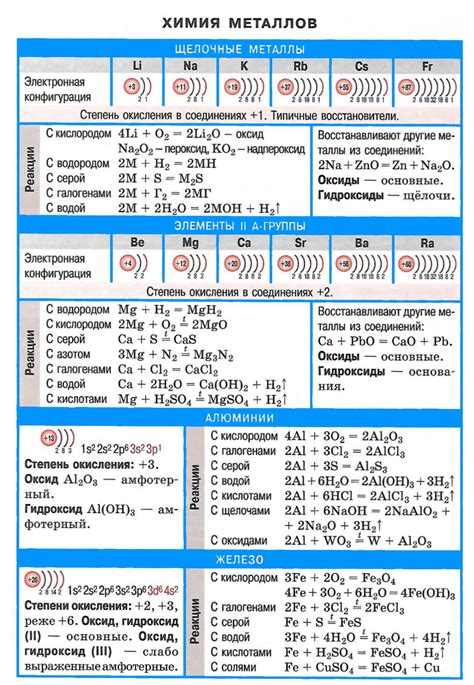
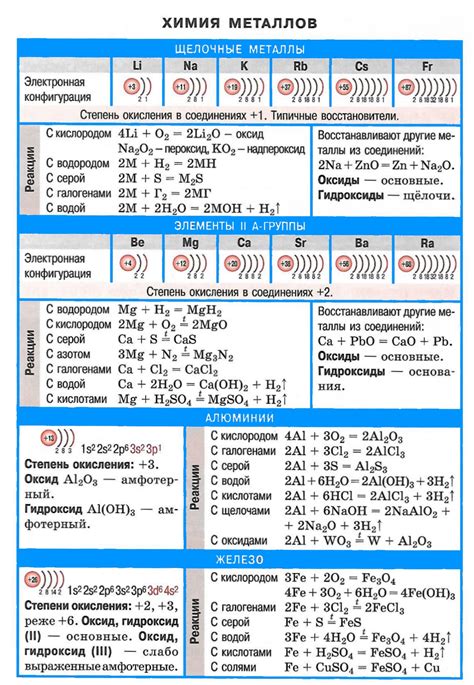
Щелочные металлы и кислоты являются важными группами в химии. Щелочные металлы представлены элементами первой группы периодической системы, такими как литий, натрий, калий и другие. Кислоты, в свою очередь, являются химическими соединениями, которые образуются при реакции водорода с неметаллами или при растворении некоторых соединений в воде.
Щелочные металлы характеризуются общей формулой MO, где M - металл из группы щелочных металлов, а O - кислород. Основные свойства щелочных металлов включают высокую реактивность, низкую температуру плавления и кипения, а также способность образовывать ионы с положительным зарядом. Они реагируют с кислородом, водой и неметаллами, образуя оксиды, гидроксиды и соли.
Кислоты, с другой стороны, образуются при реакции водорода с неметаллами или при растворении некоторых соединений в воде. Они характеризуются наличием гидрофильной группы, такой как карбоксильная или сульфоновая, которая отвечает за кислотные свойства. Кислоты могут быть органическими или неорганическими соединениями, и их свойства могут сильно варьировать в зависимости от состава и структуры.
Примерами щелочных металлов являются литий, натрий и калий, которые широко используются в различных областях промышленности и науки. Примерами кислот могут служить серная кислота, уксусная кислота и соляная кислота, которые находят применение в производстве и в быту.
Формула и свойства щелочных металлов и кислот
Щелочные металлы представляют собой группу элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Формула щелочных металлов обычно представляется как M, где M - символ конкретного элемента. Щелочные металлы обладают рядом характерных свойств.
- Во-первых, щелочные металлы обладают низкой плотностью и мягкостью. Это связано с их электронной структурой и образованием легких и прочных связей между атомами.
- Во-вторых, щелочные металлы активно реагируют с водой, образуя гидроксиды и выделяя водород. Реакция щелочных металлов с водой сопровождается выделением большого количества тепла.
- Кроме того, щелочные металлы образуют стабильные ионные соединения с отрицательно заряженными атомами. Например, хлорид натрия (NaCl) является одним из наиболее распространенных соединений щелочных металлов.
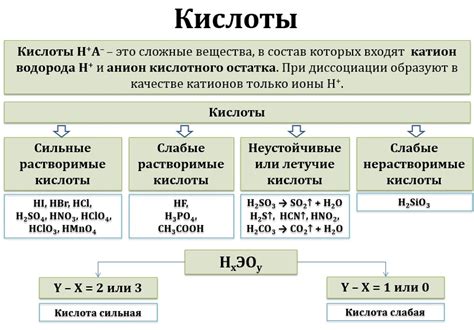
Кислоты представляют собой вещества, способные отдавать протоны (водородные ионы) при реакции. Формула кислоты может быть представлена как HnA, где H - водород, A - атом или группа атомов, а n - число водородных атомов.
- Сильные кислоты: например, серная кислота (H2SO4) и соляная кислота (HCl), известные своей высокой кислотностью и способностью растворять металлы.
- Слабые кислоты: например, уксусная кислота (CH3COOH) и лимонная кислота (C6H8O7), которые имеют меньшую кислотность и могут использоваться в пищевой промышленности.
- Амфотерные кислоты: это вещества, которые могут проявлять свойства как кислоты, так и основания. К ним относятся, например, вода (H2O) и амфотерный оксид алюминия (Al2O3).
Взаимодействие щелочных металлов с кислотами приводит к образованию солей и выделению водорода. Это явление широко используется в химической промышленности и научных исследованиях.
Щелочные металлы: определение и основные характеристики

Щелочные металлы - это группа элементов в периодической системе химических элементов, которые обладают очень низкой электроотрицательностью и высокой реактивностью. К основным представителям щелочных металлов относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Характерной особенностью щелочных металлов является их способность образовывать ионы с положительным зарядом, так как они имеют одну валентную электронную оболочку, легко отдающую единственный электрон. Это делает их очень реактивными и химически активными элементами.
Щелочные металлы обладают также остальными характерными свойствами, такими как металлический блеск, низкая плотность, низкая температура плавления и кипения. Они легко растворимы в воде и образуют щелочные растворы, что и объясняет их название. Реакция щелочных металлов с водой сопровождается выделением водорода и образованием гидроксида металла.
Основные свойства щелочных металлов также включают высокую электропроводность, способность образовывать летучие соединения, активность в реакциях с кислородом и неметаллами, а также некоторые металлические свойства, такие как хорошая пластичность и тугоплавкость.
Таким образом, щелочные металлы представляют собой группу элементов с высокой реактивностью и специфическими химическими свойствами, что делает их важными для различных промышленных и научных приложений.
Свойства щелочных металлов: химическая активность и реакционная способность
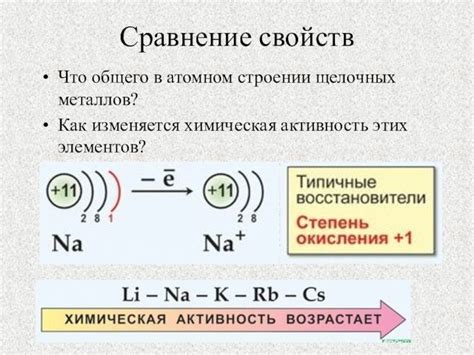
Щелочные металлы - это элементы I группы периодической системы, включающей литий, натрий, калий, рубидий, цезий и франций. Их отличает высокая химическая активность и реакционная способность, которая определяется наличием одной валентной электронной оболочки.
Щелочные металлы легко реагируют с кислородом, водой, а также многими неметаллами. Они отличаются способностью образовывать ионы, уступая свой электрон, что делает их сильными восстановителями. В результате реакций образуются соединения щелочных металлов, например, оксиды, гидроксиды и соли.
Щелочные металлы проявляют реакционную способность при взаимодействии с водой. При этом они образуют гидроксиды, это щелочи, и выделяются водород. Реакция их взаимодействия с водой проходит очень интенсивно, с выделением большого количества тепла. Например, реакцию лития с водой сопровождает появление пламени.
В реакциях с кислородом щелочные металлы образуют оксиды. Эти оксиды обладают щелочными свойствами и растворяются в воде, образуя гидроксиды.
Сочетание высокой химической активности и реакционной способности делает щелочные металлы нестабильными и легко воспламеняющимися. Их хранение и использование требует особых мер предосторожности.
Формула кислоты: структура и состав

Формула кислоты является основным понятием в химии, которое позволяет определить состав и структуру данного соединения. Кислота представляет собой химическое вещество, содержащее один или несколько атомов водорода, способных передавать положительный ион гидрогена (H+).
Структура кислоты определяется наличием таких основных элементов, как водород (H), кислород (O) и другие химические элементы, которые вводятся через приставки к основной формуле. Например, приставка "серная" в формуле означает наличие серы (S), а приставка "азотная" - наличие азота (N).
Состав кислоты определяется количеством атомов каждого элемента в молекуле. Например, кислота серной серы (H2SO4) состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (O). Количество атомов указывается через подстрочные индексы, расположенные справа от символа элемента.
Формула кислоты также может включать дополнительные группы атомов, называемые функциональными группами. Эти группы позволяют определить классификацию кислоты и ее химические свойства. Например, карбоновая кислота, содержащая группу -COOH, обладает карбонильной функциональной группой.
Таким образом, формула кислоты является ключевым инструментом для определения состава и структуры данного соединения. Она позволяет химикам классифицировать кислоты, а также изучать их свойства и реакции в химических процессах.
Свойства кислот: коррозия и ожоги, степень опасности
Кислоты - это химические вещества, обладающие кислотными свойствами. Они способны реагировать с металлами, причиняя им различные изменения. Одним из свойств кислот является их способность вызывать коррозию металлов. Коррозия - это процесс разрушения металлической поверхности под воздействием кислоты.
В результате химической реакции между кислотой и металлом образуются продукты, приводящие к образованию коррозионных растрескиваний, выбухания и расшатывания конструкций. Такая коррозия может быть особенно опасной в случае использования металлических конструкций в строительстве, авиации и других отраслях, где безопасность играет ключевую роль.
Кроме того, при попадании кислоты на кожу или внутрь организма, она может вызвать ожоги различной степени тяжести. Это связано с тем, что кислоты обладают высокой реакционной способностью и могут разрушать клетки человеческого организма.
Степень опасности кислот зависит от их свойств и концентрации. Некоторые кислоты, такие как серная, азотная и соляная кислоты, являются сильными и могут вызвать серьезные ожоги даже при кратковременном контакте с кожей. В то же время, некоторые слабые кислоты, например, уксусная или лимонная кислоты, обычно менее опасны для здоровья человека.
При работе с кислотами необходимо соблюдать особые меры предосторожности, такие как использование защитной одежды, респираторов и защитных очков. Также важно знать и применять правила расчета концентрации кислоты, чтобы избежать несчастных случаев и минимизировать риск коррозии при использовании металлических конструкций.
Примеры взаимодействия щелочных металлов и кислот: реакции и их значимость
Литий и вода: Литий реагирует с водой, образуя гидроксид лития (LiOH) и выделяя водород (H2). Эта реакция является очень активной и сопровождается искрой и пламенем. Гидроксид лития имеет широкое применение в производстве аккумуляторов, а также в производстве стекла и керамики.
Натрий и соляная кислота: Натрий реагирует с соляной кислотой, образуя хлорид натрия (NaCl) и выделяя водород (H2). Эта реакция проводится в лаборатории для получения хлорида натрия, который широко используется в пищевой промышленности и в производстве стекла.
Калий и серная кислота: Калий реагирует с серной кислотой, образуя сульфат калия (K2SO4) и выделяя диоксид серы (SO2) и воду (H2O). Сульфат калия используется в сельском хозяйстве как удобрение, а также в производстве стекла, мыла и фармацевтических препаратов.
Рубидий и азотная кислота: Рубидий реагирует с азотной кислотой, образуя нитрат рубидия (RbNO3) и выделяя оксид азота (NO) и воду (H2O). Нитрат рубидия используется в пиротехнике и для производства стекла с высоким показателем преломления.
Цезий и соляная кислота: Цезий реагирует с соляной кислотой, образуя хлорид цезия (CsCl) и выделяя водород (H2). Цезий является самым реактивным щелочным металлом и используется в научных исследованиях и в производстве электронных приборов.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают несколькими общими свойствами. Они являются мягкими металлами, имеют низкую плотность и низкую температуру плавления. Щелочные металлы хорошо растворяются в воде и образуют щелочные растворы. Они реагируют с кислородом и водой, образуя оксиды и гидроксиды. Щелочные металлы также являются хорошими проводниками электричества и тепла.
Какую формулу имеет щелочный гидроксид?
Щелочные металлы образуют гидроксиды с формулой MOH, где М обозначает щелочный металл. Например, гидроксид лития имеет формулу LiOH, гидроксид натрия - NaOH, гидроксид калия - KOH. Гидроксиды щелочных металлов являются сильными основаниями и хорошо растворяются в воде.
