Реакция щелочных металлов с кислотами является одной из основных химических реакций, которая происходит при взаимодействии этих соединений. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, имеют высокую химическую активность и реакционную способность.
Особенностью реакции щелочных металлов с кислотами является образование соли и выделение водорода. При этом металл замещает водород в кислоте, образуя соль и высвобождаяся молекулы водорода. Например, реакция лития с соляной кислотой приводит к образованию хлорида лития и выделению молекул водорода:
2Li + 2HCl = 2LiCl + H2
Эта реакция происходит с выделением тепла и сопровождается характерными сизыми шипящим звуком, что является одной из особенностей этой химической реакции.
Формула реакции щелочных металлов с кислотами общая: M + HA = MA + H2, где M - щелочной металл, HA - кислота, MA - соль. Эта формула отображает общую суть реакции, которая происходит при взаимодействии указанных соединений.
Щелочные металлы в химии
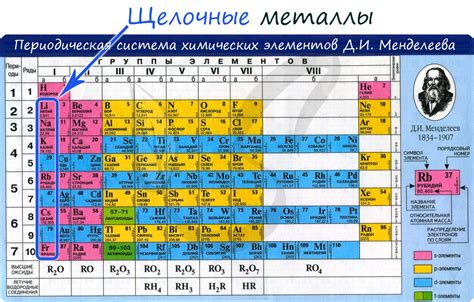
Щелочные металлы - это металлические элементы, которые обладают особенными химическими свойствами. Они относятся к первой группе периодической системы и включают в себя литий, натрий, калий, рубидий, цезий и франций.
Щелочные металлы имеют низкую плотность и очень мягкие, легко режущиеся металлические свойства. Они обладают низкой точкой плавления и кипения, что делает их хорошими кандидатами для использования в различных промышленных процессах.
Одной из главных характеристик щелочных металлов является их реакция с кислотами. Когда щелочные металлы вступают в контакт с кислотой, происходит сильное химическое взаимодействие. Результатом этой реакции является образование соли и выделение водорода.
Реакция щелочных металлов с кислотами основана на обмене ионами. При этом ионы металла заменяют ионы водорода в молекуле кислоты, образуя соль. Например, реакция натрия с серной кислотой приводит к образованию натрия сульфата и выделению водорода:
- 2Na + H2SO4 → Na2SO4 + H2
Такие реакции широко используются в лабораторных и промышленных условиях для получения различных солей и выделения водорода.
Важно отметить, что реактивность щелочных металлов с кислотами возрастает по мере движения по группе. Так, литий наиболее реактивен, а франций - наименее.
Таким образом, знание о реакции щелочных металлов с кислотами является важным в химии, позволяя проводить синтез различных соединений и определять свойства щелочных металлов.
Общая формула реакции

Реакция щелочных металлов с кислотами представляет собой химическую реакцию, при которой щелочные металлы образуют соли и выделяются водород.
Общая формула реакции можно записать следующим образом:
М + HX -> MX + H2,
где М представляет собой щелочный металл (например, натрий, калий), HX - кислоту (например, соляную кислоту, серную кислоту), MX - соответствующую соль (например, хлорид натрия, сульфат калия), H2 - молекулы водорода.
В результате реакции щелочный металл реагирует с кислотой, образуя соль, которая содержит ионы металла и ионы аниона кислоты. При этом выделяется молекула водорода, которая образует пузырьки газа.
Общая формула реакции является упрощенной записью, которая позволяет описать основные изменения, происходящие в ходе реакции щелочного металла с кислотой. В реальности могут быть некоторые дополнительные химические превращения, в зависимости от конкретных условий и использованных реагентов.
Особенности реакции щелочных металлов с кислотами
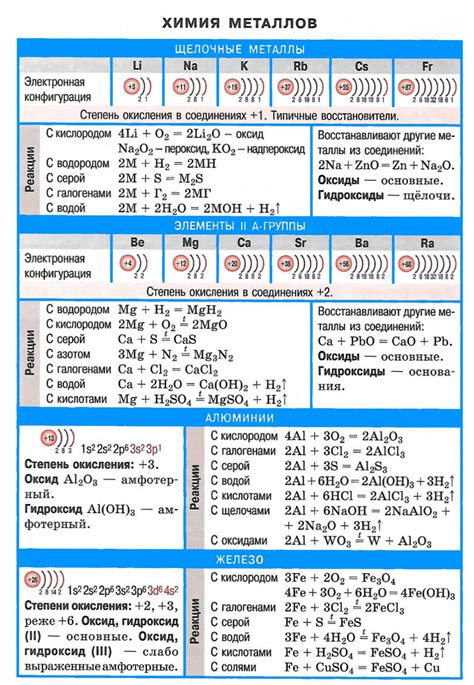
Реакция щелочных металлов с кислотами представляет собой химическую реакцию, при которой образуются соли и выделяется водород. Эта реакция особенно характерна для щелочных металлов, таких как литий, натрий и калий, которые находятся в первой группе периодической системы.
В ходе реакции щелочный металл сначала реагирует с кислородом из кислоты, образуя оксид металла. Затем оксид металла реагирует с водой, образуя гидроксид металла и выделяя водородный газ. Гидроксид металла, в свою очередь, может дальше реагировать с кислотой, образуя соль и воду.
Реакция щелочных металлов с кислотами часто сопровождается яркими химическими реакциями, такими как пузырчатый выход водорода и образование вещества с ярко выраженным цветом. Эта реакция может также сопровождаться выделением тепла, что говорит о том, что она является экзотермической.
Примером реакции щелочного металла с кислотой может быть реакция натрия с соляной кислотой:
- Na + HCl → NaCl + H2
В данном случае натрий (Na) реагирует с соляной кислотой (HCl), образуя хлорид натрия (NaCl) и выделяя водород (H2). Эта реакция заметна благодаря пузырькам водорода, которые образуются во время реакции.
Вопрос-ответ

Какие виды щелочных металлов существуют?
В природе существует шесть видов щелочных металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какой химической реакцией характеризуется взаимодействие щелочных металлов с кислотами?
Взаимодействие щелочных металлов с кислотами протекает по общей формуле: М + HX = MX + H2, где М обозначает щелочной металл, HX - кислота, MX - соль щелочного металла, а H2 - молекулярный водород.
Какие особенности имеет реакция щелочных металлов с кислотами?
Взаимодействие щелочных металлов с кислотами происходит с выделением водорода и образованием солей щелочных металлов. При этом реакция сильно экзотермическая и сопровождается выделением тепла. Кроме того, щелочные металлы могут реагировать с кислотами только при наличии воды, так как реакция включает образование водорода.
