Оксиды металлов – это химические соединения, которые образуются при реакции металла с кислородом. Формула оксида металла показывает, какие элементы входят в состав данного соединения и в каком соотношении. Структура оксида металла определяет его физические и химические свойства.
Строение оксида металла в зависимости от его формулы может быть различным. Некоторые оксиды обладают ионной структурой, где металлический элемент образует катион, а кислород – анион. Такие соединения имеют высокую точку плавления и твердые кристаллические структуры.
Другие оксиды металлов могут иметь молекулярную структуру, где атомы металла и кислорода связаны ковалентной связью. В этом случае оксиды имеют газообразное или жидкое состояние при комнатной температуре. Такие соединения обладают низкой температурой плавления и кипения, а также характерными физическими свойствами.
Кроме того, формула оксида металла может указывать на содержание воды в данном соединении. Например, оксиды металлов с формулой M2O имеют высокую степень окисления металла и являются основаниями. В свою очередь, оксиды металлов с формулой MOH включают воду и обладают щелочными свойствами.
Важно отметить, что формула оксида металла непосредственно связана с его свойствами. Например, оксиды металлов с простой формулой MO обычно обладают щелочными свойствами и являются основаниями, тогда как оксиды металлов с более сложной формулой, например MO2, могут обладать кислотными свойствами и являться окислителями.
Научное определение и классификация

Оксид металла - химическое соединение, состоящее из атомов металла, связанных с атомами кислорода. По своей сущности, оксиды металлов являются солями кислорода и химически наиболее распространенными оксидами.
Оксиды металлов могут быть классифицированы по структуре и свойствам. По структуре можно выделить две основные группы: ионные и молекулярные оксиды.
Ионные оксиды образуются в результате реакции металла с кислородом и характеризуются тем, что их составляют ионы металла и ионы кислорода. Примерами ионных оксидов являются оксиды щелочных металлов, такие как оксид натрия (Na2O) и оксид калия (K2O).
Молекулярные оксиды металлов состоят из молекул, в которых атомы металла связаны с атомами кислорода. Примерами молекулярных оксидов являются двуокись углерода (CO2) и оксид серы (SO2).
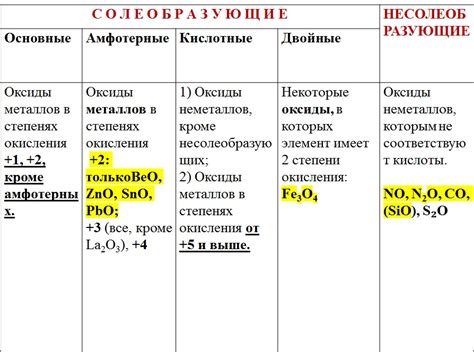
Классификация оксидов металлов по свойствам включает оксиды, которые действуют как основания, и оксиды, которые действуют как кислоты. Оксиды, обладающие щелочными свойствами, реагируют с водой, образуя гидроксиды металлов. Они способны нейтрализовать кислоты и образовывать соли. Примерами таких оксидов являются оксид калия (K2O) и оксид натрия (Na2O).
Оксиды с кислотными свойствами могут реагировать с основаниями и образовывать соли. Они также могут реагировать с водой, образуя кислоты. Примерами кислотных оксидов являются оксид серы (SO2) и оксид азота (NO2).
Межатомная связь и кристаллическая решетка оксидов металлов
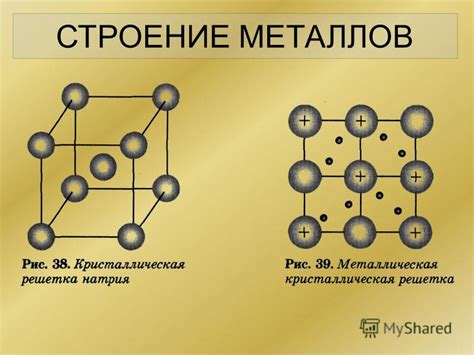
Межатомная связь – это основной фактор, который определяет структуру и свойства оксидов металлов. Оксиды металлов, которые образуются при взаимодействии металлов с кислородом, обладают определенной кристаллической решеткой, которая обеспечивает устойчивость и прочность материала.
Кристаллическая решетка оксидов металлов имеет определенную структуру, которая включает в себя упорядоченное расположение атомов. Структура может быть ионной, ковалентной или металлической, в зависимости от типа связи между атомами металла и кислорода. Например, оксиды металлов с двухвалентными и трихвалентными ионами имеют ионную структуру, где межатомные связи образованы электростатическими притяжениями между положительно и отрицательно заряженными ионами. В то же время, оксиды металлов с металлической связью имеют металлическую структуру, где атомы металла тесно связаны между собой путем обмена электронами.
Кристаллическая решетка оксидов металлов может иметь различные типы, такие как кубическая, тетрагональная, гексагональная и другие. Форма решетки определяется взаимодействием между атомами металла и кислорода, а также факторами, такими как размеры атомов, электронное строение и температура. Изменение структуры решетки может повлиять на свойства оксидов металлов, такие как проводимость электричества и их термохимическую стабильность.
Типы оксидов металлов: основные, кислотные и амфотерные оксиды
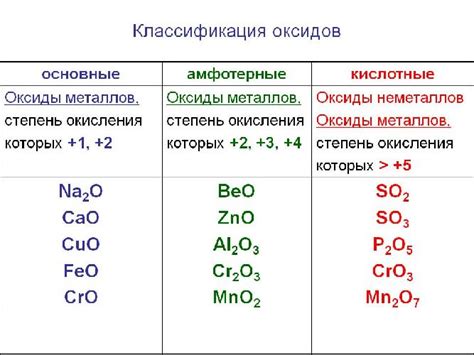
Оксиды металлов являются соединениями состоящими из кислорода и одного или нескольких металлов. Они представляют собой важный класс химических соединений с разнообразными свойствами.
Существует несколько типов оксидов металлов, в зависимости от их химической природы и свойств. Основные оксиды, также известные как щелочные оксиды, образуют растворы с щелочной реакцией и реагируют с водой, образуя гидроксиды металлов.
Кислотные оксиды, также известные как ангидриды, реагируют с водой, образуя кислоты и имеют кислую реакцию. Они могут использоваться в процессах дегидрации или как катализаторы в химических реакциях.
Амфотерные оксиды обладают способностью проявлять как кислотные, так и основные свойства в зависимости от условий реакции. Эти оксиды могут реагировать как с кислотами, так и с основаниями.
Важно отметить, что тип оксида металла определяется его элементарными свойствами и электрохимическими характеристиками. Эти различия в свойствах позволяют оксидам металлов играть важную роль в промышленности и научных исследованиях, а также иметь широкий спектр применения в различных сферах человеческой жизни.
Физические свойства оксидов металлов: температура плавления и кипения
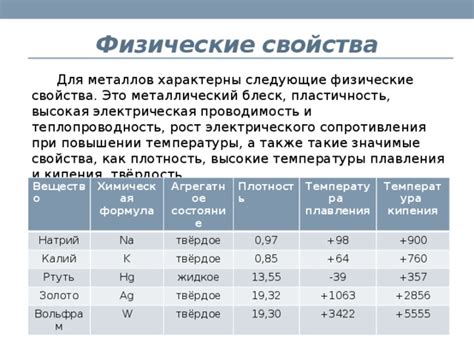
Оксиды металлов представляют собой химические вещества, образующиеся при соединении металла с кислородом. Они имеют различные физические свойства, включая температуру плавления и кипения.
Температура плавления оксидов металлов зависит от химической и физической природы металла и кислорода, и может варьировать в широких пределах. Некоторые оксиды, например, оксиды лития и натрия, имеют низкую температуру плавления и плавятся уже при комнатной температуре. В то же время, более тяжелые металлы, такие как свинец и железо, имеют намного более высокую температуру плавления оксидов.
Температура кипения оксидов металлов также зависит от различных факторов. Она может быть связана с составом оксида, структурой его молекул или кристаллической структурой. Оксиды металлов с малой молекулярной массой и простой структурой обычно имеют низкую температуру кипения. Напротив, оксиды металлов с более сложным строением и молекулярной массой обычно имеют более высокую температуру кипения.
Связь между температурой кипения и температурой плавления оксидов металлов может быть использована для определения их степени чистоты. Если оксид металла имеет точку плавления и кипения, близкие по значению, это может указывать на его высокую степень чистоты и химическую стабильность.
Химические свойства оксидов металлов: реакция с водой и кислотами

Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они обладают различными химическими свойствами и могут проявлять активность при взаимодействии с водой и кислотами.
Реакция оксидов металлов с водой может протекать по двум различным сценариям. Некоторые оксиды металлов, например, оксиды щелочных металлов, растворяются в воде, образуя гидроксиды металлов. Эта реакция происходит с выделением тепла и сопровождается образованием щелочной среды.
Другие оксиды металлов, такие как оксиды алюминия и железа, не растворяются в воде, но могут реагировать с ней при нагревании. В этом случае происходит окисление металла и образование соответствующего гидроксида.
Оксиды металлов также могут взаимодействовать с кислотами. Кислоты обладают способностью отдавать протоны, а оксиды металлов – способностью вступать в реакцию с протонами. При взаимодействии оксида металла с кислотой образуется соль и вода. Реакция может протекать с выделением тепла и сопровождаться образованием газов, особенно при взаимодействии с сильными кислотами.
Таким образом, химические свойства оксидов металлов определяют их способность взаимодействовать с водой и кислотами. Это является основой для практического применения оксидов металлов в различных областях, включая промышленность, медицину и бытовые нужды.
Применение оксидов металлов в промышленности и научных исследованиях
Оксиды металлов широко используются как в промышленности, так и в научных исследованиях благодаря своим уникальным структурным свойствам и химической активности. Они играют важную роль в различных отраслях, включая электротехнику, керамику, катализ и энергетику.
Одно из основных применений оксидов металлов - электротехника. Например, оксид меди (CuO) широко используется в производстве полупроводниковых приборов, таких как диоды и транзисторы. Он обладает полезными свойствами, такими как высокая теплопроводность и электропроводность, что делает его идеальным материалом для электроники.
Кроме того, оксиды металлов используются в керамике. Например, оксид алюминия (Al2O3), известный как алюминиевая керамика, имеет высокую температурную стойкость и химическую инертность. Это позволяет использовать алюминиевую керамику для изготовления термостойких предметов, таких как керамические ножницы или части для ракет и спутников.
Оксиды металлов также находят применение в области катализа. Например, оксид цинка (ZnO) является эффективным катализатором в различных химических процессах. Он используется для преобразования различных веществ при высоких температурах, к примеру, в процессах синтеза аммиака или удаления вредных веществ из отходов.
Наконец, оксиды металлов играют важную роль в сфере энергетики. Например, оксид никеля (NiO) используется в литий-ионных аккумуляторах, которые являются одним из наиболее распространенных типов аккумуляторов. Оксид никеля улучшает электропроводность и стабильность аккумулятора, что позволяет увеличить его емкость и продолжительность работы.
Таким образом, оксиды металлов имеют множество применений в различных отраслях промышленности и научных исследованиях. Их уникальные структурные свойства и химическая активность делают их ценными материалами для создания новых технологий и улучшения существующих процессов.
Вопрос-ответ

Какая структура у оксида металла?
Структура оксида металла может быть разной. Например, некоторые оксиды металлов имеют ионную структуру, где металл образует положительный ион, а кислород – отрицательный. Другие оксиды металлов могут иметь ковалентную структуру, в которой атомы металла и кислорода связаны ковалентными связями.
Какие свойства имеют оксиды металлов?
Оксиды металлов обладают различными свойствами в зависимости от конкретного оксида. Некоторые оксиды металлов обладают кислотными свойствами, что означает, что они реагируют с водой и образуют кислотные растворы. Другие оксиды металлов являются щелочными и реагируют с водой, образуя щелочные растворы. Также некоторые оксиды металлов могут обладать амфотерными свойствами, то есть они могут реагировать как с кислотами, так и с щелочами.
Какие металлы образуют оксиды?
Практически все металлы образуют оксиды. Некоторые из них — натрий, калий, кальций, магний, алюминий, железо, медь, свинец, цинк и т.д.
Какие оксиды металлов являются наиболее распространенными?
Некоторые из наиболее распространенных оксидов металлов включают оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO), оксид магния (MgO), оксид алюминия (Al2O3), оксид железа (Fe2O3), оксид меди (CuO), оксид свинца (PbO), оксид цинка (ZnO) и др.
Какие области применения имеют оксиды металлов?
Оксиды металлов имеют широкое применение в различных областях. Например, оксиды металлов используются в качестве катализаторов, в производстве стекла и керамики, в электронике, в производстве аккумуляторов, а также как красители и пигменты.
