Эквивалентная масса металла - это значение массы, которой эквивалентно одно электрохимическое вещество или ион металла, принимая во внимание его различные степени окисления. Определение эквивалентной массы металла играет ключевую роль в рассмотрении различных аспектов электрохимических реакций и процессов.
Формула для вычисления эквивалентной массы металла может быть представлена следующим образом:
Эквивалентная масса металла = (Молекулярная масса металла) / (Электрохимический эквивалент металла)
Молекулярная масса металла - это сумма атомных масс атомов, составляющих молекулу металла. Она может быть найдена в химических таблицах или рассчитана исходя из состава молекулы металла и известных атомных масс элементов.
Электрохимический эквивалент металла - это количество электрического заряда, который освобождается или поглощается при окислении или восстановлении одного эквивалента металла в электролитической или гальванической реакции. Он зависит от степени окисления металла и может быть определен экспериментально.
Определение формулы вычисления эквивалентной массы металла
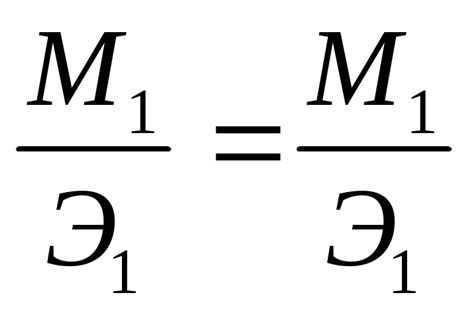
Эквивалентная масса металла - это масса металла, необходимая для образования 1 электрохимического эквивалента. Она является важным показателем в аналитической химии для расчета количества вещества и массы металла, участвующей в химической реакции или электрохимическом процессе.
Для вычисления эквивалентной массы металла необходимо использовать формулу, которая зависит от типа реакции или процесса, в котором металл участвует.
Для реакций окисления-восстановления, где металл переходит из одного окислительного состояния в другое, эквивалентная масса металла определяется по изменению его степени окисления. Формула для вычисления эквивалентной массы металла в этом случае представляет собой отношение молярной массы металла к изменению его степени окисления.
Для электролиза или электрохимических реакций, где металл выступает в качестве электрода, эквивалентная масса металла определяется по формуле, которая учитывает заряд и количество электронов, участвующих в реакции на аноде или катоде.
Для органической химии также существует формула для вычисления эквивалентной массы металла, которая учитывает его реакционную способность и число эквивалентов, образовываемых в результате химической реакции с органическим соединением.
Что такое эквивалентная масса металла
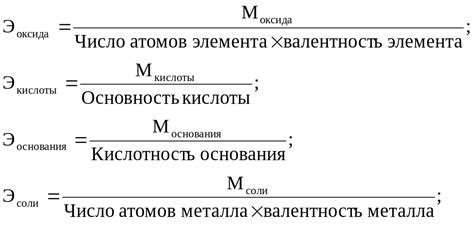
Эквивалентная масса металла - это значение массы, которая соответствует одному эквиваленту данного металла. Эквивалент - это количество вещества, способное взаимодействовать с одним молем водорода или с одним молем электронов. Таким образом, эквивалентная масса металла показывает, сколько граммов данного металла содержится в одном эквиваленте его вещества.
Формула вычисления эквивалентной массы металла зависит от его степени окисления во время реакции. Для многих металлов, у которых степень окисления постоянна, эквивалентная масса равна атомной массе металла, деленной на его заряд. Например, для железа, у которого степень окисления равна +2, эквивалентная масса будет равна молярной массе железа, поделенной на 2.
Однако, для некоторых металлов степень окисления может изменяться в разных соединениях. В таких случаях формула вычисления эквивалентной массы будет сложнее и будет зависеть от конкретной реакции. Например, для железа в соединении FeCl3 его степень окисления равна +3, поэтому эквивалентная масса железа будет равна молярной массе железа, поделенной на 3.
Факторы, влияющие на эквивалентную массу металла

Эквивалентная масса металла - это величина, определяющая количество этого металла, которое вступает в реакцию с другими веществами. Она зависит от нескольких факторов, о которых важно знать:
- Атомная масса металла: эквивалентная масса металла прямо зависит от его атомной массы. Чем больше масса атома металла, тем больше его эквивалентная масса.
- Валентность металла: эквивалентная масса металла также зависит от его валентности. Чем больше валентность металла, тем меньше его эквивалентная масса.
- Степень окисления: степень окисления металла также влияет на его эквивалентную массу. Чем больше степень окисления, тем больше его эквивалентная масса.
- Состояние металла: состояние металла (например, в виде ионы или атома) может также влиять на его эквивалентную массу. Например, если металл находится в виде иона, его эквивалентная масса будет равна его заряду, а не массе его атома.
- Степень чистоты: степень чистоты металла также может влиять на его эквивалентную массу. Нечистоты и примеси в металле могут изменять его реакционные свойства и, следовательно, его эквивалентную массу.
В целом, эквивалентная масса металла является величиной, специфичной для каждого металла и зависит от его физических и химических свойств. Знание факторов, влияющих на эквивалентную массу металла, позволяет более точно проводить расчеты и понимать реакционные свойства металлов.
Химические свойства металла

1. Реактивность и способность к реакциям
Металлы обладают высокой реактивностью, что позволяет им участвовать в различных химических реакциях. Одним из основных свойств металлов является способность активно взаимодействовать с кислородом из воздуха, образуя оксиды металлов. Активность металлов может варьироваться в зависимости от их положения в ряду активности, где наиболее реактивные металлы находятся выше по ряду, а наименее реактивные – ниже.
2. Устойчивость к коррозии
Металлы довольно часто подвергаются процессу коррозии, т.е. разрушению в результате химических реакций с окружающей средой. Однако у различных металлов уровень коррозии может сильно варьироваться. Например, металлы, такие как золото и платина, обладают высокой устойчивостью к коррозии, тогда как железо и алюминий подвержены коррозии при определенных условиях.
3. Образование сплавов
Металлы имеют свойство образовывать сплавы, т.е. смеси двух или более металлов. Образование сплавов позволяет улучшить некоторые физические и химические свойства металла, такие как прочность, пластичность и стойкость к коррозии. Примером сплава является бронза, состоящая из меди и олова, а также сталь, состоящая из железа и углерода.
4. Способность к ионизации
Металлы легко отдают электроны и образуют положительные ионы. Ионизация металлов относится к основным химическим свойствам металлов и позволяет им выступать в качестве восстановителей или доноров электронов в реакциях. Благодаря этому свойству металлы активно участвуют в электрохимических реакциях, что находит широкое применение в различных областях науки и техники.
Фазовый состав металла

Фазовый состав металла – это распределение различных фаз внутри его структуры. Металлы обладают сложной кристаллической структурой, состоящей из атомов, сгруппированных в кристаллические решетки.
Основные фазы, которые могут присутствовать в металлах, включают кристаллы основного металла, интерметаллиды и включения. Кристаллы основного металла представляют собой области, состоящие из одного или нескольких металлических элементов. Интерметаллиды – это фазы, в которых атомы разных металлов соединены в определенной структуре. Включения могут быть неоднородностями, такими как оксиды, нитриды или карбиды.
Распределение фаз в металле может влиять на его свойства и процессы, такие как деформация, термическая обработка и коррозия. Фазы металла могут быть искусственно изменены путем различных методов, включая изменение состава и структуры, а также термическую и механическую обработку.
Для анализа фазового состава металла используются различные методы, включая рентгеноструктурный анализ (XRD), электронный микроскоп (SEM) и энергодисперсионную рентгеновскую спектроскопию (EDS). Эти методы позволяют исследователям определить типы и количество различных фаз, а также их распределение в металле.
Знание фазового состава металла является важным для понимания его свойств и возможности контроля их в процессе производства и использования. Изменение фазового состава может повлиять на механические, физические и химические свойства металла и, следовательно, на его способность выполнять определенные функции и служить в различных областях применения.
Степень чистоты металла
Степень чистоты металла является важным показателем для формулы вычисления эквивалентной массы металла. Чистота металла определяется количеством примесей и инородных включений, которые могут влиять на его химические свойства.
Для определения степени чистоты металла проводятся специальные аналитические исследования, в ходе которых определяется содержание различных элементов в металлическом образце. В зависимости от требований и назначения металла, его чистота может варьироваться.
Степень чистоты металла может быть выражена в процентах или долях. Например, для высокочистого металла степень чистоты может составлять 99,99%, что означает, что в металле присутствуют незначительные примеси только в количестве 0,01%. Такая высокая чистота требуется, например, при производстве полупроводников или лазерных кристаллов.
Степень чистоты металла может также быть определена по международным стандартам и спецификациям. В таком случае, металл может быть классифицирован на различные степени чистоты в соответствии с установленными требованиями.
Определение степени чистоты металла имеет большое значение при расчете эквивалентной массы металла, поскольку примеси и прочие инородные включения могут влиять на массовую долю основного металла и его химические свойства. Чем выше степень чистоты металла, тем более точный результат дает расчет эквивалентной массы.
Примеры вычисления эквивалентной массы металла
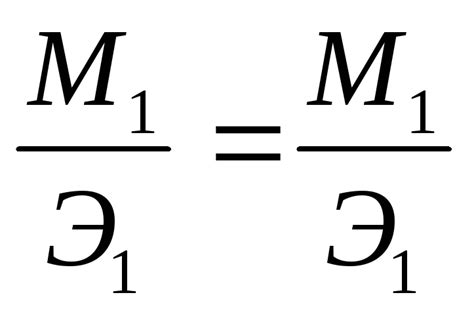
Эквивалентная масса металла является важным показателем в химии и используется для определения массы металла, которая взаимодействует с другими веществами. Рассмотрим несколько примеров вычисления эквивалентной массы металла:
Пример 1:
Пусть имеется 1 моль цинка (Zn), молярная масса которого равна 65,38 г/моль. Для вычисления эквивалентной массы металла необходимо разделить молярную массу на валентность металла. Валентность цинка равна 2, так как он образует две положительные ионы Zn2+ при взаимодействии с другими веществами. Таким образом, эквивалентная масса цинка равна 65,38 г/моль / 2 = 32,69 г/моль.
Пример 2:
Рассмотрим медь (Cu) и ее окислительно-восстановительное действие. В стандартных условиях 1 моль Cu способен передать 2 электрона. Молярная масса меди равна 63,55 г/моль. Для вычисления эквивалентной массы металла необходимо разделить молярную массу на валентность металла, то есть 63,55 г/моль / 2 = 31,78 г/моль.
Пример 3:
Анализируем железо (Fe) как важный металл в органических и неорганических реакциях. Эквивалентная масса железа может быть вычислена с учетом различных степеней окисления. Например, в случае, когда железо имеет степень окисления +2, его молярная масса равна 55,85 г/моль. Таким образом, эквивалентная масса железа будет равна 55,85 г/моль / 2 = 27,93 г/моль.
Вывод: вычисление эквивалентной массы металла является важным шагом при проведении химических реакций и исследований. Оно позволяет определить точное количество металла, необходимое для взаимодействия с другими веществами, что обеспечивает надежные результаты исследований.
Вычисление эквивалентной массы меди

Эквивалентная масса меди - это масса меди, соединение или соединения которой могут образовать один эквивалент реактивного вещества.
Для вычисления эквивалентной массы меди необходимо знать атомную массу и валентность металла. Атомная масса меди составляет приблизительно 63,546 г/моль. Валентность меди может варьироваться в зависимости от видов химических соединений.
Процесс вычисления эквивалентной массы меди можно разделить на несколько этапов:
- Определение валентности меди в соединении, для которого требуется вычислить эквивалентную массу.
- Умножение атомной массы меди на валентность, чтобы получить эквивалентную массу меди в г/эквивалент.
- Приведение эквивалентной массы меди к граммам, если необходимо.
Например, если валентность меди в реакции составляет 2, то эквивалентная масса меди будет равна 63,546 г/моль * 2 = 127,092 г/эквивалент. Если необходимо привести эквивалентную массу к граммам, необходимо знать количество эквивалентов меди, которые принимают участие в химической реакции.
Таким образом, вычисление эквивалентной массы меди является важным шагом при проведении химических расчетов и является основой для определения количества вещества меди, участвующего в реакциях.
Вопрос-ответ

Что такое эквивалентная масса металла?
Эквивалентная масса металла - это масса данного металла, которая соответствует 1 молю электролитического эквивалента вещества при участии его в электрохимической реакции.
Какая формула позволяет вычислить эквивалентную массу металла?
Формула для вычисления эквивалентной массы металла зависит от вида химической реакции, в которой участвует данный металл. Например, для расчета эквивалентной массы металла при окислительно-восстановительной реакции используют следующую формулу: эквивалентная масса металла = молекулярная масса металла / изменение его степени окисления.
Зачем нужно знать эквивалентную массу металла?
Знание эквивалентной массы металла позволяет рассчитать количество металла, необходимое для проведения электрохимических реакций. Это важно при производстве различных химических соединений, электролиза, гальванической покрытой, гальванической батареи и т. д.
Какие факторы могут влиять на эквивалентную массу металла?
Факторы, которые могут влиять на эквивалентную массу металла, включают его степень окисления, молекулярную массу, место в периодической системе элементов и условия реакции, в которой участвует металл.
Как правильно использовать формулу для вычисления эквивалентной массы металла?
Для правильного использования формулы для вычисления эквивалентной массы металла необходимо знать молекулярную массу металла и изменение его степени окисления в данной реакции. Затем нужно подставить эти значения в формулу, чтобы получить эквивалентную массу металла.
