Реакция металла и кислоты – это процесс, в результате которого происходит образование соли и выделение водорода. Данный тип химической реакции имеет свои особенности, и его принципы можно объяснить на основе электрохимических реакций.
Суть реакции металла и кислоты заключается в том, что металлический ион замещает водородный ион в кислоте, образуя соль и высвобождая водород. Это происходит из-за разности электрохимического потенциала металла и водорода. Металл, имея отрицательный потенциал, способен притягивать положительные ионы, в результате чего он отстаивает водород от кислоты и занимает его место.
Принципиальное значение реакции металла и кислоты заключается в ее применении в различных областях. Например, такая реакция является основой для получения солей, которые широко используются в промышленности, медицине, сельском хозяйстве и других отраслях. Соли, полученные в результате этой реакции, представляют собой важные химические соединения, которые имеют разнообразное применение.
Реакция металла и кислоты также играет важную роль в создании электрохимических источников тока. Батареи и аккумуляторы работают на основе именно таких реакций, где металл замещает водород и выделяется электрическая энергия. Такое применение реакции металла и кислоты лежит в основе работы многих устройств и технологий современного мира.
Принципы формулы реакции металла и кислоты
Введение

Формула реакции металла и кислоты является основой для понимания и описания химической реакции, которая происходит при взаимодействии металла и кислоты. Эта формула включает в себя информацию о химическом составе и стехиометрии реагентов, а также о продуктах реакции. Понимание принципов формулы реакции металла и кислоты позволяет провести анализ и оценку химической реакции, а также прогнозировать ее результаты.
Определение формулы реакции

Формула реакции металла и кислоты состоит из химических символов и чисел, которые показывают какие именно вещества участвуют в реакции и в каких пропорциях. Формула реакции может быть записана в виде химического уравнения, где слева от знака равенства указаны реагенты, а справа - продукты реакции.
Принципы формулы реакции металла и кислоты

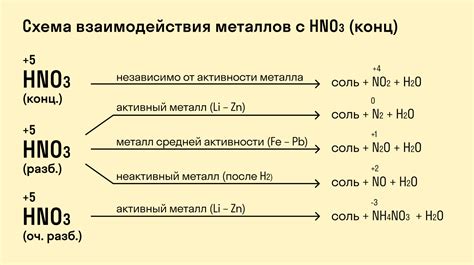
1. Металл реагирует с кислотой, образуя соль и выделяя водород. Формула реакции может быть записана следующим образом: металл + кислота = соль + водород.
2. Реакция между металлом и кислотой происходит при наличии воды в реакционной среде. Вода является необходимым компонентом для образования ионов в растворе.
3. Реагенты и продукты реакции должны быть сбалансированы с точки зрения атомных и зарядовых балансов. Это означает, что число атомов каждого элемента на левой стороне должно быть равно числу атомов на правой стороне, а сумма положительных и отрицательных зарядов также должна быть равной.
Применение формулы реакции металла и кислоты
Формула реакции металла и кислоты имеет практическое применение в различных областях химии, включая аналитическую, органическую и неорганическую химию.
Например, формула реакции металла и кислоты может быть использована для расчета протекания реакции и определения количества реагентов и продуктов реакции.
Применение формулы реакции металла и кислоты также позволяет провести анализ реакции на основе известных данных о химических свойствах металлов и кислот, а также предсказать результаты реакции в разных условиях.
Заключение

Формула реакции металла и кислоты является ключевым инструментом для понимания и анализа химической реакции между металлом и кислотой. Знание принципов и применение этой формулы позволяет углубить понимание химических процессов и развить умение проводить анализ и прогнозирование реакции. В итоге, формула реакции металла и кислоты способствует развитию науки и технологии в области химии и имеет практическое значение во многих сферах нашей жизни.
Как происходит реакция металла и кислоты

Реакция металла и кислоты является важным химическим процессом, который основывается на обмене протонами между активными ионами металла и ионами водорода кислоты. Эта реакция может протекать между различными металлами и кислотами, включая сильные и слабые кислоты.
Когда металл погружается в кислоту, он реагирует с ионами водорода кислоты, образуя соль и освобождая молекулы водорода. В зависимости от активности металла и концентрации кислоты, реакция может протекать с различной скоростью и интенсивностью.
Реакция металла и кислоты является экзотермической, то есть сопровождается выделением тепла. При этом могут возникать пузырьки газа, изменяться цвет и состав реагирующих веществ, а также происходить выделение паров воды.
Применение реакции металла и кислоты широко используется в различных областях, включая химическую промышленность, металлообработку и аналитическую химию. Например, она может применяться для очистки поверхности металла от окислов и загрязнений, а также для определения концентрации кислоты в растворе.
Важно отметить, что реакция металла и кислоты может протекать при определенных условиях, включая наличие влаги и подходящей температуры. Также необходимо учитывать, что некоторые металлы, такие как золото и платина, не реагируют с кислотами и могут быть использованы в различных антикоррозионных и электронных приложениях.
Важность правильного соотношения металла и кислоты
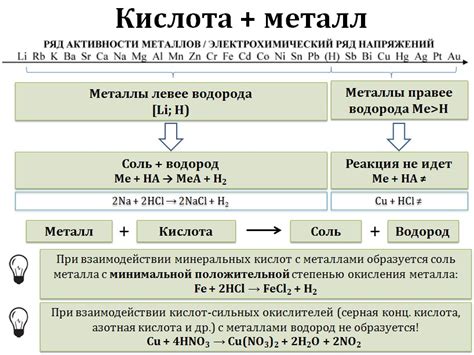
Правильное соотношение металла и кислоты имеет важное значение для успешной реакции и получения нужного продукта. Как известно, металлы могут реагировать с кислотами, вытесняя водород и образуя соли. Однако, для того чтобы реакция прошла эффективно, необходимо соблюдать определенные пропорции.
Прежде всего, необходимо учитывать химическую активность металла и кислоты. Как правило, более активные металлы, такие как натрий или калий, реагируют более быстро и интенсивно с кислотами. Однако, слишком высокая активность металла может привести к разрушению кислоты или даже к взрыву. Поэтому необходимо выбирать металл с учетом его активности и уровня безопасности реакции.
Важно также учитывать соотношение эквивалентов металла и кислоты. Это позволяет определить не только общее количество веществ, но и их взаимодействие, что может оказать влияние на ход реакции и получаемые продукты. Соотношение эквивалентов может быть определено на основе химических формул и массовой доли веществ.
Некорректное соотношение металла и кислоты может привести к неполной реакции или образованию нежелательных продуктов. Поэтому важно тщательно рассчитывать соотношение металла и кислоты перед проведением реакции. Это позволит получить желаемые вещества, избежать потери материалов и обеспечить безопасность проведения реакции.
Факторы, влияющие на скорость реакции

Скорость реакции между металлом и кислотой может зависеть от нескольких факторов. Одним из важных факторов является концентрация кислоты. Чем выше концентрация кислоты, тем быстрее протекает реакция. Это обусловлено тем, что большее количество частиц кислоты увеличивает вероятность их столкновения с металлом.
Еще одним фактором, влияющим на скорость реакции, является температура. При повышении температуры скорость реакции увеличивается, так как увеличивается средняя скорость движения молекул и увеличивается их энергия. Высокая температура способствует ускоренному образованию и реакции между металлом и кислотой.
Один из важных факторов, влияющих на скорость реакции, - это поверхность металла. Чем больше поверхность металла, тем больше поверхности контакта с кислотой и тем быстрее протекает реакция. Поверхность металла можно увеличить, разделив его на мелкие частицы или использовав порошок.
Также влияние на скорость реакции оказывает наличие катализаторов. Катализаторы ускоряют реакцию, не изменяя своего состава. Они повышают эффективность столкновения молекул кислоты и металла, что приводит к увеличению скорости реакции.
Наконец, скорость реакции может зависеть от электромагнитных полей. Электромагнитные поля могут оказывать влияние на движение и взаимодействие молекул, что может повлиять на скорость реакции между металлом и кислотой.
- Концентрация кислоты
- Температура
- Поверхность металла
- Наличие катализаторов
- Электромагнитные поля
Роль катализаторов в реакции металла и кислоты
Катализаторы играют важную роль в реакции металла и кислоты, ускоряя ее протекание и повышая эффективность процесса. Катализаторы – это вещества, которые не участвуют в реакции напрямую, но способны активировать реагенты и изменять скорость реакций.
В реакции металла и кислоты катализаторы помогают преодолеть энергетический барьер, который замедляет процесс. Они обеспечивают активацию металла и кислоты, позволяя им столкнуться таким образом, чтобы реакция проходила быстрее и эффективнее.
Кроме того, катализаторы могут изменять механизм реакции, делая ее более селективной. Они могут направлять реакцию в определенное направление, образуя определенные продукты или предотвращая образование нежелательных побочных продуктов.
Катализаторы широко применяются в промышленности для ускорения реакции металла и кислоты. Они позволяют снизить затраты на производство, улучшить качество продукции и сделать процесс более экологически безопасным. Благодаря катализаторам реакция металла и кислоты может проходить при более низких температурах и давлениях, что сокращает энергозатраты и повышает эффективность процесса.
Применение формулы реакции металла и кислоты в промышленности

Формула реакции металла и кислоты находит широкое применение в различных отраслях промышленности. Одной из таких отраслей является химическая промышленность. Здесь формула реакции металла и кислоты используется для производства различных химических соединений.
Применение формулы реакции металла и кислоты также можно найти в производстве металлургических материалов. Например, для получения металлических солей, используемых в различных отраслях промышленности, проводят реакцию металла с кислотой с последующими этапами очистки и концентрирования полученного раствора.
Формула реакции металла и кислоты применяется также в производстве аккумуляторных батарей. Например, в процессе производства свинцово-кислотных аккумуляторов используется реакция свинца с серной кислотой, которая приводит к образованию сернокислого свинца и электрическому заряду в аккумуляторе.
В сельском хозяйстве формула реакции металла и кислоты имеет свое применение в области удобрений. Например, при производстве азотных удобрений реакция железа с азотной кислотой приводит к образованию нитрата железа, который является одним из основных компонентов таких удобрений.
Применение формулы реакции металла и кислоты в промышленности является важным и неотъемлемым процессом. Оно позволяет получать различные химические соединения, материалы и продукты, необходимые для многих отраслей экономики.
Вопрос-ответ

Какую формулу имеет реакция металла и кислоты?
Обычно формула реакции металла и кислоты выглядит так: металл + кислота → соль + водород.
Что происходит в результате реакции металла и кислоты?
В результате реакции металла и кислоты образуется соль и выделяется водород. Соль обычно представляет собой ионную соединение металла и кислоты.
Какие металлы реагируют с кислотами?
Многие металлы могут реагировать с кислотами, но скорость и интенсивность реакции может зависеть от типа металла и кислоты. Реакционными металлами обычно являются щелочные и щелочноземельные металлы, такие как натрий, калий, магний, алюминий и цинк.
Какие кислоты используются в реакции с металлами?
Для реакции с металлами обычно используются различные кислоты, такие как соляная кислота (HCl), азотная кислота (HNO3) и серная кислота (H2SO4). Каждая кислота может обладать различными свойствами и взаимодействовать с металлом по-разному.
Где применяется реакция металла и кислоты?
Реакция металла и кислоты имеет широкий спектр применений. Например, она используется в химическом анализе для определения присутствия или содержания определенных металлов в образцах. Также реакции металла и кислоты применяются в образовательных целях, для демонстрации химических реакций и основных принципов химии.
