Высшие оксиды щелочных металлов представляют собой соединения, в которых металл связан с наибольшим количеством кислорода. Формула высшего оксида щелочного металла обычно имеет вид MO2, где M обозначает щелочный металл (например, Na, K, Li) или MO, где M обозначает щелочный металл, а O обозначает кислород.
Характер высшего оксида щелочного металла определяется его расположением в периодической таблице и свойством металла. В основном, высшие оксиды щелочных металлов обладают сильным окислительным и основным характером. Они способны окислять другие вещества и реагировать с водой.
Высшие оксиды щелочных металлов имеют широкое применение в различных отраслях промышленности. Например, пероксид натрия (Na2O2) используется как кислородосодержащая добавка в пищевых продуктах и в водоподготовке. Пероксид калия (K2O2) используется в химическом производстве и медицине.
Высшие оксиды щелочных металлов являются важными соединениями, которые находят широкое применение в различных отраслях науки и промышленности. Их формула и характер определяют их свойства и способность реагировать с другими веществами.
Свойства и состав высшего оксида щелочных металлов

Высшие оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O), имеют сходные свойства и состав.
Составом высшего оксида щелочных металлов является сочетание одного атома металла и двух атомов кислорода. Эти оксиды являются анионными, то есть обладают отрицательным зарядом и могут образовывать соли с положительно заряженными ионами.
Одним из главных свойств высших оксидов щелочных металлов является их щелочность. Они обладают высоким pH и могут растворяться в воде, образуя щелочные растворы. Эта свойство делает их ценными составными частями многих промышленных и бытовых продуктов, таких как моющие средства и щелочные батарейки.
Высшие оксиды щелочных металлов обладают также высокой реактивностью и могут способствовать горению. Они реагируют с влагой и создают высокотемпературные реакции, что приводит к возгоранию некоторых веществ. Именно поэтому они часто используются в процессах горения и получения огня.
Другим важным свойством высших оксидов щелочных металлов является то, что они являются сильными окислителями. Они способны окислять многие элементы, например, металлы, серу и углерод. Благодаря этому свойству они нашли применение в различных химических процессах и в производстве.
Выводящий параграф на тему: высшие оксиды щелочных металлов обладают сходным составом и свойствами. Они являются щелочными, реактивными и сильными окислителями. Благодаря этим свойствам они широко используются в различных областях промышленности и быта.
Химическая формула и структура оксида
Оксид щелочных металлов - это химическое соединение, состоящее из атомов металла и кислорода. Химическая формула оксида щелочного металла имеет вид M2O, где M обозначает атом металла. Порядок формулы указывает на то, что в одной молекуле оксида находится два атома металла и один атом кислорода.
Структура оксида щелочных металлов имеет ионную природу. Атомы металла в оксиде теряют электроны и превращаются в положительные ионы. Кислородный атом получает эти электроны и становится отрицательным ионом. Таким образом, оксид имеет формулу М2O, где металлические ионы M2+ образуют кристаллическую решетку, а вокруг них образуются отрицательные ионы О2-.
Структурные особенности оксида щелочного металла делают его стабильным и неподвижным в пространстве. Это позволяет оксиду легко взаимодействовать с другими веществами при различных химических реакциях. Оксиды щелочных металлов широко используются в различных областях, включая промышленность, медицину и сельское хозяйство.
Основные характеристики оксида щелочных металлов

Высший оксид щелочных металлов представляет собой химическое соединение, образованное из щелочного металла и кислорода. Такие металлы включают натрий, калий, литий, рубидий и цезий, и их оксиды являются основными окислителями в химических реакциях.
Оксиды щелочных металлов обладают рядом характеристик, которые отличают их от других типов оксидов. Во-первых, они образуют гигроскопические соединения, то есть способны притягивать влагу из воздуха и образовывать гидроксиды. Это делает их особенно реактивными, так как они могут растворяться в воде или образовывать щелочные растворы.
Во-вторых, оксиды щелочных металлов обладают высокими температурами плавления и кипения. Это связано с их кристаллической структурой и сильными межатомными связями, которые способствуют их стабильности. Высокая термическая стабильность делает их полезными в различных процессах, таких как производство стекла и эмали.
Третьей характеристикой оксидов щелочных металлов является их щелочной характер. Это означает, что они образуют гидроксиды с щелочной реакцией в водном растворе. Эти реактивные растворы могут использоваться в различных областях, включая промышленность, медицину и производство удобрений.
В целом, оксиды щелочных металлов - это важные химические соединения, которые обладают уникальными свойствами. Их использование широко распространено в различных областях и они являются неотъемлемой частью современной химической промышленности.
Физические свойства оксида

Оксид щелочных металлов - это химическое соединение, которое образуется в результате взаимодействия щелочного металла с кислородом. Физические свойства оксида зависят от конкретного металла, из которого он состоит.
Одним из основных физических свойств оксида щелочных металлов является его твердость. Оксиды щелочных металлов обычно представляют собой кристаллические вещества, которые обладают высокой твердостью и хрупкостью. Их кристаллическая структура обеспечивает им прочность и устойчивость.
Еще одно важное физическое свойство оксида щелочных металлов - его цвет. Оксиды щелочных металлов могут иметь различные цвета, в зависимости от химического состава и структуры. Например, оксид натрия обычно имеет белый цвет, а оксид калия - желтый или коричневый.
Температурный расширительный коэффициент является еще одним важным физическим свойством оксида щелочного металла. В зависимости от конкретного оксида и условий, при которых он находится, он может расширяться или сжиматься при изменении температуры. Это свойство может быть использовано, например, для создания термисторов или других устройств, которые реагируют на изменение температуры.
Также следует отметить электропроводность оксида щелочного металла. Оксиды щелочных металлов обычно обладают высокой электропроводностью. Это связано с наличием свободных электронов, которые могут легко перемещаться в структуре соединения. Именно электропроводность оксида позволяет использовать его в электронике и других технических областях.
Химические свойства оксида щелочных металлов

Оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O), обладают рядом уникальных химических свойств.
Во-первых, оксиды щелочных металлов обладают щелочными свойствами. Это означает, что они растворяются в воде, образуя гидроксиды. Гидроксиды щелочных металлов, в свою очередь, являются сильными щелочами, способными образовывать щелочные растворы.
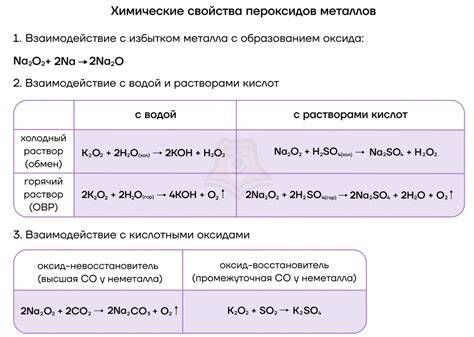
Во-вторых, оксиды щелочных металлов реагируют с кислородом, образуя пероксиды. Например, оксид натрия (Na2O) при взаимодействии с кислородом образует пероксид натрия (Na2O2).
В-третьих, оксиды щелочных металлов обладают свойством гидратации. Они могут поглощать влагу из окружающей среды, образуя гидраты. Гидраты оксидов щелочных металлов могут быть использованы в качестве сушильных агентов.
В-четвертых, оксиды щелочных металлов образуют соли с кислотами. Например, оксид натрия (Na2O) реагирует с соляной кислотой (HCl), образуя хлорид натрия (NaCl) и воду (H2O).
- Оксиды щелочных металлов обладают щелочными свойствами.
- Они реагируют с кислородом, образуя пероксиды.
- Оксиды щелочных металлов могут гидратироваться и поглощать влагу.
- Они образуют соли с кислотами.
Реакция оксида щелочных металлов с водой
Оксиды щелочных металлов – это химические соединения, состоящие из атомов металла и кислорода. Последний присутствует в оксиде в разных степенях окисления. Свойства оксида щелочного металла определяются его формулой и характером.
Реакция оксида щелочного металла с водой является одной из наиболее характерных реакций данного соединения. При взаимодействии с водой оксид щелочного металла претерпевает гидратацию, то есть связывается с молекулами воды. Оксид щелочного металла растворяется в воде, образуя щелочь – гидроксид металла.
Например, оксид натрия Na2O, взаимодействуя с водой, образует натриевую гидроксид NaOH. Реакция протекает с выделением тепла и образованием гидроксида металла в виде раствора:
- Na2O + H2O → 2NaOH
Аналогично оксид калия K2O взаимодействуя с водой, образует калиевую гидроксид KOH:
- K2O + H2O → 2KOH
Реакция оксида щелочного металла с водой сопровождается выделением большого количества тепла и образованием раствора гидроксида металла.
Таким образом, реакция оксида щелочных металлов с водой позволяет получать гидроксиды металлов, которые имеют широкое применение в различных отраслях промышленности и научных исследованиях.
Применение высших оксидов щелочных металлов

Высшие оксиды щелочных металлов имеют широкий спектр применений в различных отраслях промышленности и научных исследованиях. Они обладают уникальными свойствами, которые делают их полезными в различных областях.
Во-первых, высшие оксиды щелочных металлов широко применяются в электрохимической промышленности, в частности, в производстве аккумуляторов. Эти оксиды служат важным компонентом активной массы положительных электродов и обеспечивают высокую электропроводность и стабильное электрохимическое поведение. Это позволяет создавать более эффективные и долговечные аккумуляторы.
Во-вторых, высшие оксиды щелочных металлов используются в производстве стекла и керамики. Например, оксид натрия (Na2O) используется для придания прозрачности стеклу и повышения его устойчивости к химическим агентам. Оксид калия (K2O) обладает высокой точкой плавления и применяется для производства различных видов керамики, включая электрокерамику и изоляторы.
В-третьих, высшие оксиды щелочных металлов находят применение в производстве красителей и пигментов. Например, оксид железа (Fe2O3) используется для производства красок и красителей различных оттенков, от ярко-красного до желтого. Оксид хрома (Cr2O3) применяется в производстве зеленых и неферрозеленых пигментов.
В-четвертых, высшие оксиды щелочных металлов широко используются в качестве катализаторов в различных химических процессах. Натриевый и калиевый оксиды обладают кислотно-основными свойствами и усиливают реакции окисления и гидрогенирования, что делает их ценными катализаторами.
Таким образом, использование высших оксидов щелочных металлов распространено в электрохимической промышленности, производстве стекла и керамики, производстве красителей и пигментов, а также в качестве катализаторов. Эти вещества играют значительную роль в различных отраслях и доказывают свою эффективность в различных приложениях.
Вопрос-ответ

Какая формула высшего оксида щелочных металлов?
Формула высшего оксида щелочных металлов обычно записывается как M2O, где M обозначает щелочной металл (например, Na, K, Li). Таким образом, высший оксид натрия будет иметь формулу Na2O, а высший оксид калия - формулу K2O.
В чем заключается характер высшего оксида щелочных металлов?
Высшие оксиды щелочных металлов характеризуются своей основностью. Они реагируют с водой, образуя щелочные растворы. Кроме того, они претерпевают реакцию с кислородом и действуют как основание при взаимодействии с кислотами.
Можно ли указать пример высшего оксида щелочного металла?
Да, конечно. Примером высшего оксида щелочного металла является оксид натрия (Na2O). Он обладает основными свойствами и может реагировать с водой, образуя щелочную соль NaOH. Этот оксид также может действовать как основание и реагировать с кислотами, образуя соответствующие соли.
Почему высший оксид щелочного металла является основным?
Высший оксид щелочного металла является основным, потому что он может образовывать щелочные растворы при реакции с водой. Это связано с тем, что высший оксид содержит щелочной металл и кислород. Когда оксид вступает в реакцию с водой, щелочной металл образует ион гидроксида, что и приводит к образованию щелочного раствора.
