Оксиды металлов являются одной из наиболее распространенных классов неорганических соединений. Они образуются при взаимодействии металлов группы с кислородом и представляют собой химические соединения, в которых металл соединяется с одним или более атомами кислорода. Оксиды металлов имеют широкий спектр физических и химических свойств и широко используются в различных отраслях промышленности и науке.
Образование оксидов металлов при взаимодействии с кислородом происходит на основе принципа окислительно-восстановительных реакций. В процессе окисления металла кислородом образуются оксиды, в которых металл имеет положительную степень окисления. Основной фактор, влияющий на образование оксидов металлов при взаимодействии с кислородом, - это относительная активность металла и его способность вступать в химические реакции с кислородом.
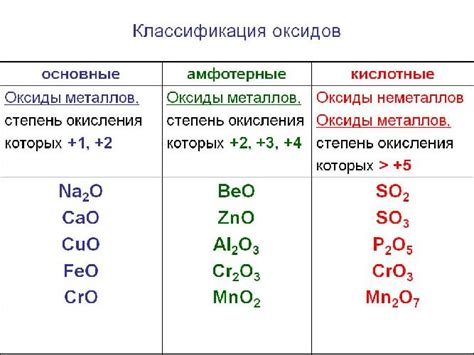
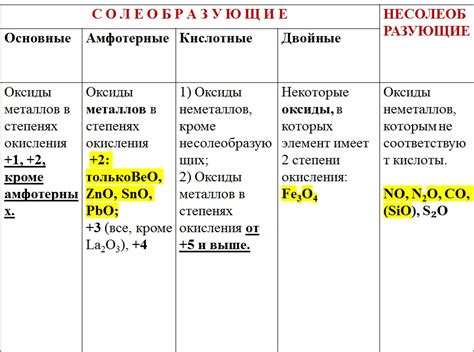
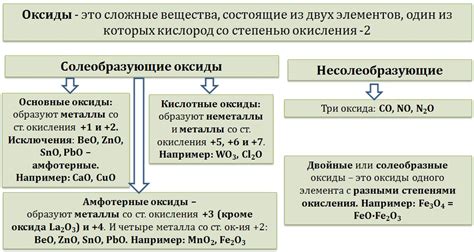
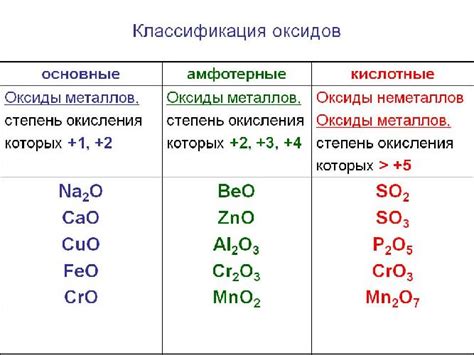
Одним из важных свойств оксидов металлов является их способность растворяться в воде и образовывать кислоты. При этом, оксиды металлов могут образовывать как кислотные оксиды, которые образуют кислоты взаимодействуя с водой, так и основные оксиды, которые образуют основания при растворении в воде. Таким образом, оксиды металлов играют важную роль в химических реакциях кислотных и щелочных растворов, а также являются важными компонентами в производстве катализаторов, электронных устройств и многих других промышленных продуктов.
Оксиды металлов группы
Оксиды металлов группы - это химические соединения, образующиеся при взаимодействии металлов с кислородом. Они играют важную роль в различных процессах и имеют широкий спектр применения.
Оксиды металлов группы обладают различными физическими свойствами, такими как цвет, твердость, плотность и т.д. Например, оксид железа, более известный как ржавчина, имеет красно-коричневый цвет, темно-коричневый оксид марганца используется в производстве стекла и керамики, а желтый оксид свинца применяется в производстве красок.
Оксиды металлов группы имеют различные степени реактивности и свойства. Некоторые оксиды металлов могут использоваться в качестве катализаторов в химических реакциях, другие - как ингредиенты для производства лаков и покрытий, а еще другие - как сырье для производства стекла, керамики и других материалов.
Оксиды металлов группы обычно имеют высокую термическую и химическую стабильность, что делает их полезными в различных отраслях промышленности. Однако они также обладают определенными токсичными свойствами и могут быть вредными для здоровья человека и окружающей среды. Поэтому необходимо соблюдать меры предосторожности при работе с оксидами металлов и обеспечивать их безопасное хранение и использование.
Оксиды металлов группы, образуемые при воздействии кислорода

Группа оксидов металлов, получаемых в результате взаимодействия металлов с кислородом, включает множество веществ, имеющих различные физические и химические свойства. Эти оксиды обладают широким спектром применений и играют важную роль в различных отраслях промышленности и научных исследованиях.
Одним из наиболее известных оксидов металлов является оксид железа (Fe2O3), который получается при окислении железа в воздухе. Этот оксид имеет красный цвет и широко используется в производстве красок, косметических и строительных материалов. Он также является основным компонентом ржавчины, которая образуется при окислении железа и стали.
Другой важный оксид металла - оксид алюминия (Al2O3), который образуется при воздействии кислорода на алюминий. Этот оксид обладает высокой термической стабильностью и используется в производстве высокотемпературных материалов, например керамики и огнеупорных изделий. Он также используется в производстве алюминиевой фольги и алюминиевых конструкций.
Кроме того, в результате взаимодействия с кислородом образуются оксиды таких металлов, как медь, цинк, свинец и другие. Эти оксиды находят применение в различных областях, включая электронику, химическую промышленность, металлургию и строительство.
Химические свойства оксидов металлов группы
Оксиды металлов группы - это соединения, образующиеся при взаимодействии металлов группы с кислородом. Они обладают определенными химическими свойствами, которые зависят от конкретного металла и условий реакции.
Одним из химических свойств оксидов металлов группы является их способность взаимодействовать с водой. Некоторые оксиды металлов группы растворяются в воде с образованием щелочных растворов. Так, например, оксид натрия (Na2O) образует щелочной раствор натрия, который обладает щелочными свойствами и используется в различных областях промышленности.
Другим важным химическим свойством оксидов металлов группы является их реактивность с кислотами. Оксиды металлов группы могут реагировать с различными типами кислот, образуя соли и воду. Например, оксид железа (Fe2O3) при взаимодействии с соляной кислотой образует хлорид железа (FeCl3) и воду.
Еще одним химическим свойством оксидов металлов группы является их реакция с основаниями. Некоторые оксиды металлов группы образуют с основаниями соли и воду. Например, оксид кальция (CaO) при взаимодействии с гидроксидом натрия (NaOH) образует сульфат кальция (CaSO4) и воду.
Также оксиды металлов группы обладают различной степенью окислительных свойств. Некоторые оксиды металлов группы могут вступать в реакции окисления, при этом сами оксиды восстанавливаются до исходного состояния. Например, оксид меди (CuO) при взаимодействии с водородом (H2) может быть восстановлен до исходного вещества - меди.
Физические свойства оксидов металлов группы

Оксиды металлов группы, образуемые при взаимодействии с кислородом, обладают различными физическими свойствами. Они могут быть как твердыми, так и газообразными. Например, оксид железа (III) (Fe2O3) является твердым веществом, известным под названием "красная руда".
Температурные свойства оксидов металлов группы также различаются. Некоторые оксиды обладают высокой температурной стабильностью и не подвергаются разложению при нагреве. Например, оксид алюминия (Al2O3) обладает высокой температурной стабильностью и используется в качестве инертного материала при производстве электролитических конденсаторов и керамических изоляторов.
Физические свойства оксидов металлов группы также определяют их механические характеристики. Некоторые оксиды металлов могут быть очень твердыми и обладать высокой твердостью, как, например, оксид кремния (SiO2), который является основным компонентом песчаника и стекла. Однако, есть и оксиды металлов, которые могут быть относительно мягкими, как, например, оксид меди (Cu2O), который может использоваться в производстве керамики и красителей.
Таким образом, физические свойства оксидов металлов группы могут быть разнообразными и зависят от их химического состава и структуры. Они могут варьироваться от твердости и температурной стабильности до механических характеристик. Изучение этих свойств позволяет использовать оксиды металлов в различных областях, включая производство строительных материалов, керамики, электроники и других промышленных отраслях.
Применение оксидов металлов группы
Оксиды металлов группы широко используются в различных областях человеческой деятельности. Они обладают множеством полезных свойств и находят применение в промышленности, медицине, электронике и других отраслях.
Одним из основных применений оксидов металлов группы является их использование в качестве катализаторов в химической промышленности. Они способны активировать химические реакции, повышая их скорость и эффективность. Благодаря этому, оксиды металлов группы применяются в процессах синтеза органических и неорганических соединений, производстве пластиков, красителей и многих других продуктов.
Оксиды металлов группы также широко используются в электронике. Они обладают полупроводниковыми свойствами и могут применяться в производстве полупроводниковых диодов и транзисторов. Кроме того, оксиды металлов группы применяются в изготовлении керамических материалов, которые используются в производстве электрических изоляторов и посуды.
Некоторые оксиды металлов группы обладают фармацевтическими свойствами и применяются в медицине. Например, оксид цинка используется в составе мазей и кремов для лечения кожных заболеваний, таких как ожоги и сыпь. Оксид кремния используется в средствах защиты от солнца, благодаря своим фотостабилизирующим свойствам.
Оксиды металлов группы также находят применение в качестве красителей и пигментов. Например, оксид железа используется при производстве красок, который применяют для окрашивания стен, металлических поверхностей и других материалов. Оксид титана широко применяется в производстве красок, пластиков, косметических средств и даже пищевых добавок.
Таким образом, оксиды металлов группы представляют широкий спектр применений в различных сферах жизни человека. Они являются важными компонентами в производстве различных материалов и продуктов, их свойства позволяют использовать их в различных отраслях промышленности и науки.
Изучение оксидов металлов группы

Оксиды металлов группы — это важные соединения, которые образуются при взаимодействии металлов с кислородом. Изучение этих оксидов позволяет расширить наши знания о свойствах и реакционной способности металлов.
При изучении оксидов металлов группы проводятся различные эксперименты, включающие синтез и анализ данных соединений. Одним из основных методов исследования является рентгеноструктурный анализ, позволяющий определить кристаллическую структуру оксидов металлов.
Также изучение оксидов металлов группы включает исследование их физических и химических свойств. Например, проводятся измерения температурного расширения, электропроводности, магнитных свойств и т.д. Эти данные позволяют получить представление о поведении оксидов металлов в различных условиях.
Изучение оксидов металлов группы имеет практическое значение. Например, они широко используются в различных отраслях промышленности, таких как катализ, производство электродов, электрохимические и термические устройства. Кроме того, некоторые оксиды металлов обладают антибактериальными свойствами и применяются в медицине для борьбы с инфекциями.
Влияние оксидов металлов группы на окружающую среду

Оксиды металлов группы являются одними из наиболее распространенных загрязнителей окружающей среды. Они образуются при взаимодействии металлов с кислородом в результате окислительных процессов.
Оксиды металлов имеют различные физические и химические свойства, и в зависимости от своих характеристик они могут оказывать различное влияние на окружающую среду. Некоторые оксиды металлов являются ядовитыми и могут вызывать заболевания у человека и животных, а также загрязнять почву и воду.
Другие оксиды металлов могут приводить к кислотным дождям, что негативно сказывается на растительности и экосистемах. Оксиды металлов также могут способствовать разрушению озонового слоя и усилению парникового эффекта, что приводит к изменению климата.
Для снижения негативного влияния оксидов металлов на окружающую среду необходимо проводить меры по очистке выбросов промышленных предприятий, разработке и внедрению современных технологий, которые позволят снизить количество образующихся оксидов металлов, а также осуществлять контроль за их выбросами.
Важно также осуществлять мониторинг уровня загрязнения окружающей среды оксидами металлов и проводить регулярные исследования для оценки их воздействия на живые организмы и окружающую среду в целом. Разработка и внедрение эффективных методов очистки и обезвреживания оксидов металлов является важной задачей для сохранения экологической безопасности и здоровья населения.
Реакции оксидов металлов группы с различными веществами
Оксиды металлов группы обладают разнообразными свойствами и могут проявлять активную реакционность при взаимодействии с различными веществами. При этом их реакционная способность зависит от свойств и степени окисления металла, а также от свойств сопряженных с ним анионов.
Реакция оксидов металлов группы с кислотами приводит к образованию солей и обычно сопровождается выделением воды. Например, оксид магния MgO реагирует с соляной кислотой HCl, образуя хлорид магния MgCl2 и воду. А оксид цинка ZnO реагирует с серной кислотой H2SO4, образуя сульфат цинка ZnSO4 и воду.
Оксиды металлов группы также могут взаимодействовать с основаниями. При этом образуются соответствующие соли и вода. Например, оксид кальция CaO реагирует с гидроксидом натрия NaOH, образуя нитрат кальция Ca(OH)2 и воду. А оксид железа(III) Fe2O3 взаимодействует с гидроксидом калия KOH, образуя ферригидроксид Fe(OH)3 и воду.
Реакция оксидов металлов группы с несобственными веществами также может протекать. Например, оксид меди(II) CuO реагирует с углеродом С, образуя металлическую медь Cu и оксид углерода(IV) CO2. А оксид железа(II) FeO может реагировать с хлором Cl2, образуя хлорид железа(III) FeCl3 и оксид хлора(I) Cl2O.
Также следует отметить возможность взаимодействия оксидов металлов группы с водой. В результате такой реакции образуются гидроксиды металлов. Например, оксид натрия Na2O реагирует с водой H2O, образуя гидроксид натрия NaOH. А оксид алюминия Al2O3 взаимодействует с водой, образуя гидроксид алюминия Al(OH)3.
Особенности оксидов металлов группы
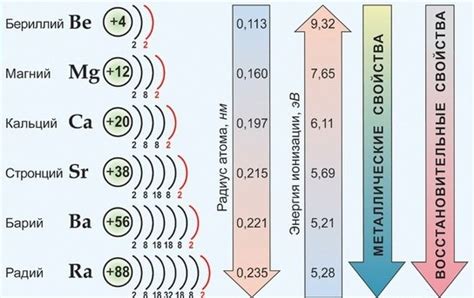
1. Различные свойства: Оксиды металлов группы имеют различные свойства в зависимости от состава и структуры. Некоторые оксиды обладают свойствами кислот, другие - свойствами оснований, а некоторые - свойствами амфотерных соединений. Также оксиды металлов группы могут обладать полупроводниковыми свойствами.
2. Роль в природе: Оксиды металлов группы имеют важное значение в природе. Например, оксиды кальция и магния являются основными компонентами каменной породы, а оксиды железа являются основными компонентами земли и руды. Оксиды металлов группы также являются неотъемлемой частью геологических процессов и циклов.
3. Роль в промышленности: Оксиды металлов группы широко используются в промышленности. Например, оксид алюминия является одним из основных материалов для производства алюминия и его сплавов. Оксиды металлов группы также используются в производстве керамики, стекла, красителей, катализаторов и других важных продуктов.
4. Свойства в химических реакциях: Оксиды металлов группы проявляют различные свойства в химических реакциях. Некоторые оксиды, такие как оксид железа, могут быть окислены или восстановлены при взаимодействии с другими веществами. Другие оксиды могут образовывать соли, амфотерные соединения или гидроксиды при реакции с кислотами или щелочами.
5. Влияние на окружающую среду: Оксиды металлов группы могут оказывать влияние на окружающую среду. Некоторые оксиды, например, оксиды серы и азота, могут быть вредными для здоровья людей и животных при попадании в атмосферу. Оксиды металлов группы также могут вносить вклад в атмосферное загрязнение и изменение климата.
Вопрос-ответ

Какие оксиды металлов образуются при взаимодействии с кислородом?
При взаимодействии металлов группы с кислородом образуются различные оксиды: оксиды щелочных металлов (например, оксид натрия Na2O, оксид калия K2O), оксиды щелочноземельных металлов (например, оксид магния MgO, оксид кальция CaO) и другие.
Для чего используются оксиды металлов?
Оксиды металлов имеют широкий спектр применений. Некоторые из них используются в качестве красителей или пигментов (например, оксид железа - основной компонент красок), другие оксиды служат важными составляющими для производства стекла или керамики. Большинство оксидов металлов также обладают каталитической активностью и могут быть использованы в процессах химической промышленности.
Каковы свойства оксидов металлов?
Свойства оксидов металлов зависят от конкретного металла и его степени окисления в соединении. В общем случае оксиды металлов обладают высокими температурами плавления и кипения, а также химической инертностью. Однако, некоторые оксиды могут быть растворимыми в воде и образовывать щелочные растворы. Кроме того, оксиды металлов могут обладать кислотными, щелочными или нейтральными свойствами в зависимости от химического характера металла и оксида.
