Щелочноземельные металлы – это группа элементов периодической системы, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они отличаются особыми физическими свойствами, которые делают их полезными в различных областях науки и промышленности.
Одно из важных физических свойств щелочноземельных металлов – это низкая плотность. Например, плотность бериллия составляет всего 1,85 г/см³, что делает его легким и прочным материалом. Также, магний имеет низкую плотность (1,74 г/см³), а кальций (1,54 г/см³) и стронций (2,63 г/см³) – плотностями среднего уровня.
Другим важным физическим свойством щелочноземельных металлов является высокая теплопроводность. Например, бериллий имеет наиболее высокую теплопроводность среди всех металлов – около 200 Вт/(м·К). Магний также обладает высокой теплопроводностью – 156 Вт/(м·К), а у кальция и стронция она составляет примерно 110 Вт/(м·К).
Кроме того, щелочноземельные металлы обладают высокой электропроводностью. Они хорошие проводники электричества за счет наличия свободных электронов в своей кристаллической решетке. Бериллий и магний относятся к группе металлов средней электропроводностью, а кальций, стронций и барий являются хорошими проводниками электричества.
В целом, физические свойства соединений щелочноземельных металлов делают их полезными материалами для различных применений. Низкая плотность делает их легкими и прочными металлами, высокая теплопроводность и электропроводность позволяют использовать их в технологиях передачи тепла и электричества.
Состав и свойства щелочноземельных металлов

Щелочноземельные металлы – это группа элементов периодической системы, которая включает в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают сходной химической активностью, что связано с их одинаковым количеством валентных электронов, равным двум.
Основные свойства щелочноземельных металлов объясняются их электронной структурой и атомным радиусом. Они являются хорошими проводниками тепла и электричества, так как имеют слабо связанные электроны в своей внешней энергетической оболочке. Благодаря этому, щелочноземельные металлы обладают высокой электропроводностью и теплопроводностью.
Еще одной характеристикой щелочноземельных металлов является низкая плотность. Из группы этих элементов бериллий имеет наименьшую плотность, а барий и радий – наибольшую. Это связано с наличием низкой атомной массы и большого размера атома в ряду элементов.
Щелочноземельные металлы реагируют с водой, хотя не так активно, как щелочные металлы. При взаимодействии с водой образуются основания – гидроксиды, при этом выделяется водород. Например, магний реагирует с водой, образуя гидроксид магния и выделяя водородный газ:
- Магний + вода → гидроксид магния + водород
- 2Mg + 2H₂O → 2Mg(OH)₂ + H₂
Щелочноземельные металлы также образуют соединения с кислотами, образуя соли. Например, реакция магния с соляной кислотой приводит к образованию хлорида магния:
- Магний + соляная кислота → хлорид магния + водород
- Mg + 2HCl → MgCl₂ + H₂
Кроме того, щелочноземельные металлы используются в различных отраслях промышленности и технологии. Например, бериллий применяется в производстве высокопрочных сплавов, магний – в авиационной и автомобильной промышленности, а стронций используется в производстве светящихся красителей и пирофорных составов.
Физические свойства группы элементов в периодической системе
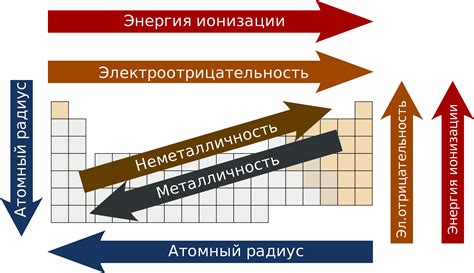
Группа элементов в периодической системе представляет собой вертикальный столбец элементов, обладающих определенными общими характеристиками. Физические свойства группы элементов могут иметь сходства или различия в зависимости от их положения в периодической системе. В данном случае рассмотрим физические свойства группы щелочноземельных металлов.
Первым физическим свойством, которое можно отметить, является металлический блеск, характерный для всех щелочноземельных металлов. Они обладают блестящей поверхностью, отражающей свет.
Вторым важным физическим свойством является большая электропроводность щелочноземельных металлов. Они легко проводят электрический ток при небольших напряжениях.
Также следует отметить низкую плотность щелочноземельных металлов. Они обладают малой массой в сравнении с объемом, что делает их легкими и прочными материалами.
Еще одним физическим свойством группы щелочноземельных металлов является низкая температура плавления и кипения. Они плавятся и испаряются при относительно низких температурах, что позволяет использовать их в различных промышленных процессах.
И наконец, высокая реактивность также отличает щелочноземельные металлы. Они активно взаимодействуют с водой, кислородом и другими химическими веществами.
Таким образом, физические свойства группы щелочноземельных металлов включают металлический блеск, высокую электропроводность, низкую плотность, низкую температуру плавления и кипения, а также высокую реактивность. Эти свойства делают щелочноземельные металлы важными материалами в различных отраслях промышленности и научных исследований.
Физические свойства металлов этой группы

Щелочноземельные металлы - это группа элементов в периодической системе, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У этих металлов есть несколько общих физических свойств, которые делают их уникальными и полезными в различных областях научных и промышленных приложений.
Первое физическое свойство - низкая плотность. Бериллий, магний, кальций, стронций и барий имеют низкую плотность, что означает, что они легкие и хорошо поддаются обработке. Из-за этой свойство они часто используются в авиации, создании легких сплавов и других применениях, где вес имеет значение.
Второе физическое свойств – высокая температура плавления. Все металлы этой группы обладают высокой температурой плавления, что делает их полезными в высокотемпературных приложениях. Например, магний используется в производстве легких сплавов для авиационной и автомобильной промышленности, а барий применяется в производстве катодов для вакуумных ламп.
Третье физическое свойство – хорошая теплопроводность. Щелочноземельные металлы отличаются высокой теплопроводностью, что означает, что они хорошо передают тепло. Это свойство делает их полезными в различных приложениях, включая производство теплообменных устройств, радиаторов и других систем охлаждения.
Четвертое физическое свойство – блеск и хорошая отражательная способность. Металлы этой группы имеют хорошую отражательную способность и блеск, что делает их полезными в производстве зеркал, отражателей и других оптических приборов.
В целом, физические свойства щелочноземельных металлов делают их важными и полезными во многих промышленных, научных и технологических областях. Эти свойства вносят вклад в их широкое использование, от горной промышленности до энергетической и светотехнической отрасли.
Щелочноземельные металлы в природе

Щелочноземельные металлы – это вторая группа периодической системы элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название из-за своей химической реактивности и сходства с щелочными металлами. В природе эти элементы распространены широко и представлены в виде различных минералов и соединений.
Бериллий в природе обычно встречается в виде минерала берилла, а также в составе различных шпатов, гранитов и некоторых горных пород. Магний находится в широком разнообразии природных соединений, таких как карнелит, доломит, серпентинит и море. Кальций является основным компонентом каменной соли и мрамора, а также присутствует в виде кальцита и гипса. Стронций обычно встречается в минералах церуссита, стронтита и барита. Барий есть в минералах барита и селенита. Радий является редким элементом и в природе встречается в следах вместе с другими радиоактивными элементами.
Щелочноземельные металлы имеют широкое применение в различных отраслях промышленности и технологии. Например, бериллий используется в производстве ядерных реакторов, электрических контактов и материалов с высокой прочностью. Магний находит применение в автомобильной промышленности, а также в производстве прочных и легких сплавов. Кальций применяется в производстве стекла, цемента и металлов, а также в сельском хозяйстве в качестве удобрения. Стронций используется в производстве пиротехники, фонариков и флуоресцентных ламп. Барий применяется в медицине для создания контрастных препаратов при рентгенологических исследованиях. Радий, главным образом из-за своей радиоактивности, находит применение в научных исследованиях и лечении рака.
Особенности структуры атомов щелочноземельных элементов

Атомы щелочноземельных элементов отличаются своей структурой от атомов других элементов, что обусловлено особыми свойствами этих элементов в периодической системе химических элементов. Щелочноземельные элементы находятся во второй группе элементов и имеют два внешних электрона. Такая структура атома часто обуславливает тот или иной набор свойств, которые являются уникальными для данной группы элементов.
Атомы щелочноземельных элементов характеризуются наличием двух электронов на внешней энергетической оболочке. Эти электроны называются валентными и значительно влияют на свойства элементов. Благодаря двум электронам на внешней оболочке, атомы щелочноземельных элементов могут образовывать ионные и ковалентные соединения с другими элементами.
Структура атомов щелочноземельных элементов имеет свои особенности, поскольку электроны распределены по определенным энергетическим оболочкам. Присутствие двух электронов на внешней оболочке создает сильную взаимодействие между атомами данной группы элементов. Это влияет на их химическую активность и способность образовывать стабильные соединения.
Важно отметить, что благодаря особой структуре атомов щелочноземельных элементов, эти элементы обладают свойствами, которые являются характерными только для данной группы в периодической системе химических элементов. Например, они обладают высокой электропроводностью, низким температурным расширением и другими физическими свойствами, которые определяются их атомными структурами.
Электронная конфигурация и химические свойства металлов группы

Металлы группы щелочных земель, состоящей из бериллия, магния, кальция, стронция, бария и радия, обладают уникальной электронной конфигурацией и химическими свойствами. Внешний электронный слой металлов этой группы содержит два электрона, что делает их химически активными и склонными к образованию ионов.
Металлы группы щелочных земель обладают высокой степенью отдельности и проводимости электрического тока, что делает их хорошими проводниками электричества. Также они обладают высокой теплопроводностью и металлическим блеском.
Химические свойства металлов группы щелочных земель в значительной степени определяются их способностью образовывать ионы с положительным зарядом. Благодаря наличию двух электронов в внешнем слое, металлы группы щелочных земель образуют ионы с зарядом +2. Это делает их очень реакционноспособными, особенно в контакте с водой или кислородом.
Металлы группы щелочных земель легко реагируют с кислородом, образуя оксиды. Например, бериллий образует оксид BeO, магний - MgO, а кальций - CaO. Эти оксиды являются основаниями и растворяются в воде, образуя щелочные растворы.
Взаимодействие металлов группы щелочных земель с водой является очень реактивным. В результате реакции с водой образуются щелочные или щелочноземельные гидроксиды и высвобождается водород. Например, реакция кальция с водой приводит к образованию гидроксида Ca(OH)2 и выделению водорода.
Физические свойства щелочноземельных соединений

Щелочноземельные соединения – это химические соединения, содержащие элементы из 2-й группы периодической системы, а именно бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Эти металлы обладают особыми физическими свойствами, которые оказывают влияние на свойства соединений, в которых они участвуют.
Точка плавления и кипения: Щелочноземельные соединения обладают высокой температурой плавления и кипения. Например, точка плавления бария составляет 727 градусов Цельсия, а точка кипения магния – около 1100 градусов Цельсия. Это связано с тем, что металлы из этой группы имеют высокую энергию связи между атомами, что требует большого количества энергии для изменения их фазы.
Твердость и прочность: Щелочноземельные соединения обладают высокой твердостью и прочностью. Они являются хрупкими и несколько ковкими материалами. Например, бериллий является одним из самых жестких элементов и используется в производстве высокопрочного сплава для изготовления ракет и космических кораблей.
Растворимость: Щелочноземельные соединения в основном растворяются в воде, образуя ионы металла и ионы гидроксида. Однако, растворимость может значительно различаться в зависимости от конкретного соединения. Например, барийсульфат является практически нерастворимым в воде, в то время как гидроксид бария является достаточно растворимым в воде.
Цветность: Щелочноземельные соединения могут обладать различной цветностью. Например, бериллиевые соединения имеют обычно бесцветную или слабо окрашенную структуру, а стронциевые соединения могут иметь красный или оранжевый цвет. Цветность обусловлена электронными переходами внутри атомов и ионов вещества.
Таким образом, щелочноземельные соединения обладают рядом интересных физических свойств, таких как высокая температура плавления и кипения, высокая твердость и прочность, вариативная растворимость и разнообразная цветность. Эти свойства делают их важными компонентами в различных отраслях промышленности и науки.
Применение щелочноземельных металлов и их соединений

Щелочноземельные металлы - это группа элементов, включающая бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом уникальных физических и химических свойств, благодаря которым находят широкое применение в различных отраслях промышленности и науки.
Магний, например, известен своей легкостью и прочностью. Именно поэтому он широко используется в авиационной и автомобильной промышленности для производства легких и прочных сплавов. Магниевые сплавы также применяются во многих других отраслях, включая производство спортивных товаров и медицинских имплантатов.
Кальций входит в состав костной ткани и играет важную роль в поддержании здоровья костей и зубов. Кальций и его соединения используются в производстве различных пищевых добавок, лекарственных препаратов и минеральных удобрений. Он также используется в строительной и металлургической промышленности.
Стронций находит применение в производстве стекла для цветного искусства, фотоники и радиационной терапии. Барий используется в производстве баритового бетона и световых чувствительных покрытий. Бериллий, благодаря своей легкости и высокой прочности, используется в аэрокосмической промышленности и производстве ядерных реакторов.
В целом, применение щелочноземельных металлов и их соединений широко распространено и включает в себя множество различных отраслей. Отсутствие схожих физических и химических свойств у этих элементов позволяет варьировать их применение в соответствии с потребностями различных отраслей промышленности и науки.
Вопрос-ответ

Каковы физические свойства щелочноземельных металлов?
Физические свойства щелочноземельных металлов включают низкую плотность, низкую температуру плавления, высокую электропроводность, мягкость и химическую реактивность.
Какова плотность щелочноземельных металлов?
Плотность щелочноземельных металлов обычно низкая. Например, плотность металла бериллия составляет около 1.85 г/см³, а плотность металла магния - около 1.74 г/см³.
Что можно сказать о температуре плавления щелочноземельных металлов?
Температура плавления щелочноземельных металлов обычно низкая. Например, температура плавления металла бериллия составляет около 1287 °C, а температура плавления металла магния - около 650 °C.
Обладают ли щелочноземельные металлы высокой электропроводностью?
Да, щелочноземельные металлы обладают высокой электропроводностью. Они являются хорошими проводниками электричества, что делает их важными материалами для различных электрических приборов и сетей.
Что можно сказать о мягкости щелочноземельных металлов?
Щелочноземельные металлы обычно мягкие и легко поддаются деформации. Например, металл магния можно нарезать ножом, а металл кальция можно размять пальцами.
