Щелочные металлы - это элементы периодической системы, которые относятся к первой группе. Эта группа состоит из лития, натрия, калия, рубидия, цезия и франция. Щелочные металлы являются самыми активными металлами и обладают рядом особых физических свойств.
Во-первых, щелочные металлы отличаются мягкостью и низкой плотностью. Они легко режутся ножом и могут быть легко разделены на части. Кроме того, у них низкая плотность, что означает, что они очень легкие и могут плавать на поверхности воды.
Во-вторых, щелочные металлы обладают высокой теплопроводностью и электропроводностью. Именно поэтому они широко используются в промышленности, включая производство батарей и электроники. Кроме того, они способны создавать яркие пламя при горении, что делает их полезными для использования в фейерверках.
Третья особенность щелочных металлов заключается в их способности реагировать с кислородом воздуха и водой. Они очень реактивны и могут легко взорваться или загореться в контакте с водой. Именно поэтому их обрабатывают с осторожностью и хранят под веществами, не взаимодействующими с ними.
Первые элементы таблицы Менделеева

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются первыми элементами в группе 1 таблицы Менделеева. Они имеют простую атомную структуру, состоящую из одного или двух электронов во внешней оболочке. Это делает их очень реактивными и способными образовывать соединения с другими элементами.
Литий - легчайший из щелочных металлов, он имеет наименьшую атомную массу и наименьший атомный радиус среди них. Литий является твёрдым металлом серебристо-белого цвета, реагирует с водой, образуя щелочной гидроксид и высвобождая водород. Кроме того, литий широко применяется в производстве аккумуляторов.
Натрий - элемент, который находим в обилии в соленых озёрах и морской воде. Золотистого цвета и мягкий на ощупь, натрий очень реактивный и быстро окисляется на воздухе. Натрий важен для поддержания правильного соотношения воды в нашем организме и также используется для производства баклажки и стекла.
Калий - это серебристо-белый металл, который был впервые получен в середине 19 века. Калий играет важную роль в работе наших клеток и нервов, помогая поддерживать нормальные уровни воды в организме. Он широко применяется в сельском хозяйстве, особенно для удобрения почвы.
Рубидий и цезий - редкие элементы, которые можно найти в следах в земной коре. Они имеют аналогичные химические свойства, как и другие щелочные металлы, и часто используются в научных исследованиях. Рубидий и цезий участвуют в различных электронных устройствах, вакуумных трубках и ксеноновых лазерах.
Атомные и молекулярные свойства

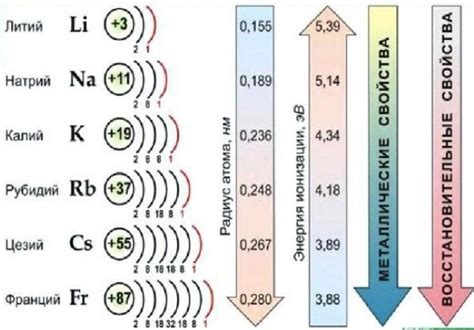
Щелочные металлы, такие как литий, натрий, калий и др., относятся к первой группе таблицы химических элементов. Они характеризуются наличием одного электрона на внешнем энергетическом уровне. Именно благодаря этому электрону, щелочные металлы обладают высокой химической активностью и быстрым вступлением в реакции.
Щелочные металлы образуют ионные соединения с анионами других элементов. Благодаря своей малой электроотрицательности, они легко отдают свой внешний электрон, образуя положительно заряженный ион, который участвует в дальнейших химических реакциях.
Атомы щелочных металлов образуют кристаллическую решетку, в которой каждый атом окружен шестью соседними атомами. Это обуславливает их высокую плотность и тугоплавкость. Кроме того, атомы внутри решетки имеют свободные электроны, которые могут перемещаться по решетке и обеспечивать электрическую проводимость металлов.
Молекулярные связи щелочных металлов образуются при взаимодействии атомов друг с другом. Они могут образовывать одноатомные молекулы, а также молекулы, содержащие несколько атомов, например, димеры или тримеры. При вступлении в химические реакции, щелочные металлы склонны образовывать ионные соединения, но также могут образовывать и ковалентные связи с другими элементами.
Электронная структура и химическая активность

Щелочные металлы - группа химических элементов, расположенных в первой группе периодической таблицы. Их атомы содержат всего одну валентную электронную оболочку, на которую приходится только один электрон. Это делает их электронную структуру очень устойчивой и обуславливает их высокую химическую активность.
Имея один электрон на валентной оболочке, щелочные металлы стремятся избавиться от него, чтобы достичь стабильной восьмиэлектронной конфигурации, подобной у благородных газов. Для этого они образуют очень легко ионизируемые катионы, теряя свой единственный валентный электрон.
Электронная структура щелочных металлов объясняет их химическую активность. В результате образования положительного иона, натрий, калий и другие металлы вступают в реакции с различными элементами. Например, они реагируют с водой, образуя гидроксиды и выделяя водород. Также они вступают в реакции с большинством неметаллических элементов, образуя ионные или ковалентные соединения.
Кроме того, химическая активность щелочных металлов проявляется в их реакциях с кислородом, галогенами и другими веществами. Они образуют оксиды, пероксиды и супероксиды, которые могут служить катализаторами при различных процессах. Способность щелочных металлов образовывать стойкие соединения и выделять энергию в реакциях способствует их активному использованию в различных областях, включая пищевую и фармацевтическую промышленность.
Металлические свойства щелочных металлов

Щелочные металлы – это группа химических элементов, которые являются металлами и принадлежат к первой группе периодической системы. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом характерных металлических свойств, которые делают их уникальными и широко используемыми в различных сферах нашей жизни.
Первое металлическое свойство щелочных металлов – это высокая электропроводность. Они являются отличными проводниками электричества, что делает их незаменимыми материалами в электротехнике. Благодаря своей способности эффективно проводить электрический ток, они используются для создания проводов и контактов во многих устройствах и системах, таких как аккумуляторы, сетевые адаптеры, электроды и т. д.
Второе важное металлическое свойство щелочных металлов – это хорошая теплопроводность. Они способны эффективно передавать тепло, что делает их полезными в различных термических приложениях. Они используются для создания тепловых радиаторов, отопительных систем, теплообменников и других устройств, которые требуют высокой теплопроводности.
Третье металлическое свойство щелочных металлов – это их высокая реакционная способность с водой и кислородом. Они реагируют с водой, образуя щелочные растворы и выделяя водород. Это выполняет важную роль в многих химических процессах и применениях. Они широко используются в батареях, при производстве луга и калия, в химической промышленности и других областях.
В общем, металлические свойства щелочных металлов делают их ценными и востребованными в различных областях науки и технологии. Их уникальные свойства позволяют им играть важную роль в нашей повседневной жизни и продолжать исследования для поиска новых способов применения этих ценных металлов.
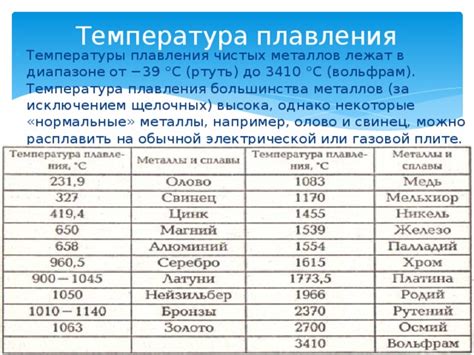
Физические свойства щелочных металлов: плавление и кипение

Щелочные металлы - это элементы первой группы периодической таблицы, такие как литий, натрий, калий и др. Они отличаются высокой реактивностью и химической активностью. Помимо этого, у щелочных металлов также есть интересные физические свойства, такие как плавление и кипение, которые рассмотрим подробнее.
Многие щелочные металлы имеют очень низкую температуру плавления, что означает, что они легко переходят из твердого состояния в жидкое при небольшом нагревании. Например, литий - самый легкий щелочный металл, имеет температуру плавления всего около 180 градусов Цельсия. Натрий и калий имеют еще ниже температуру плавления.
Важно отметить, что при плавлении щелочные металлы образуют обычно серебристые жидкости, хотя некоторые из них могут иметь желтоватый или белый оттенок. Жидкие щелочные металлы обладают низкой вязкостью и высоким теплопроводностями. Они также обладают способностью реагировать с водой, образуя газ и щелочные растворы.
Что касается температуры кипения щелочных металлов, она также низкая. Например, натрий кипит при примерно 883 градуса Цельсия, а калий приблизительно при 760 градусах Цельсия. При кипении щелочные металлы образуют пары, которые могут быть ядовитыми для организмов.
Плотность и твердость щелочных металлов
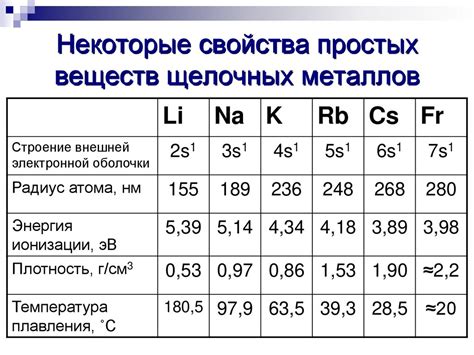
Плотность - это физическая величина, указывающая на массу вещества, которая содержится в единице объема. У щелочных металлов, таких как литий, натрий и калий, плотность является довольно низкой. Например, плотность лития составляет около 0,534 г/см³, плотность натрия - около 0,971 г/см³, а плотность калия - около 0,862 г/см³. Это означает, что эти металлы могут плавать на поверхности воды, так как их плотность меньше плотности воды.
Твердость - это свойство материала сопротивляться механическому деформированию, вызванному воздействием других твердых материалов. Щелочные металлы обладают низкой твердостью, что делает их относительно мягкими по сравнению с другими металлами. Например, твердость лития составляет около 0,6 по шкале Мооса, натрия - около 0,5, а калия - около 0,4. Это позволяет легко обрабатывать эти металлы и использовать их в различных технических и промышленных процессах.
В целом, плотность и твердость щелочных металлов определяют их свойства и способы использования в различных областях науки и промышленности. Низкая плотность позволяет им быть легкими и хорошо плавающими на поверхности жидкостей, а низкая твердость делает их удобными в обработке и использовании в различных технических задачах.
Тепло- и электропроводность щелочных металлов
Одной из важных физических характеристик щелочных металлов является их высокая теплопроводность. Теплопроводность – это способность вещества передавать тепло. Щелочные металлы, такие как литий, натрий, калий и др., обладают очень высокой теплопроводностью.
Высокая теплопроводность у щелочных металлов объясняется наличием свободных электронов в их кристаллической решетке. Электроны, будучи заряженными частицами, могут свободно передвигаться в металлическом кристалле и переносить тепло.
Также, щелочные металлы обладают высокой электропроводностью – способностью проводить электрический ток. Это связано с наличием свободных электронов, которые легко передают электрический заряд от одной частицы к другой.
Какие применения может иметь высокая тепло- и электропроводность щелочных металлов? Например, благодаря своей высокой электропроводности, щелочные металлы широко используются в электронике и электротехнике, при производстве различных электронных приборов, солнечных батарей, аккумуляторов и т.д. А благодаря своей теплопроводности, щелочные металлы активно применяются в различных отраслях, где требуется передача тепла – например, в производстве теплообменников, радиаторов и т.д.
Термохимические и радиоактивные свойства щелочных металлов
Щелочные металлы впечатляют своими термохимическими свойствами. Они хорошо реагируют с кислородом, горя и образуя оксиды, которые имеют яркие цвета. Например, литий при реакции с кислородом образует оксид Li₂O, называемый литиевым оксидом. Более того, щелочные металлы обладают способностью сжигаться в воздухе или воде при высокой температуре, проявляя яркую люминесценцию и оставляя оставки характерного окраса. Это делает их не только интересными, но и полезными в различных приложениях.
Щелочные металлы также известны своей радиоактивностью. Радиоактивность — это свойство ядерных материалов излучать радиацию. Цезий-137, который является одним из продуктов деления атома урана, обладает высокой радиоактивностью, и встречается вокруг мира в результате испытаний ядерного оружия. Калий-40, еще один изотоп щелочного металла, также является радиоактивным и естественно встречается в почве и камнях. Эти свойства щелочных металлов влияют на их использование в ядерной энергетике и медицине.
Изучение термохимических и радиоактивных свойств щелочных металлов позволяет нам лучше понять их химические и физические свойства. Они обладают уникальными способностями, которые находят широкое применение в различных областях науки и промышленности. Изучение данных свойств помогает учащимся понять важность щелочных металлов и их роли в нашей повседневной жизни.
Вопрос-ответ

Какие физические свойства имеют щелочные металлы?
Щелочные металлы обладают рядом характерных физических свойств. Во-первых, они мягкие и легкие, так как имеют низкую плотность. Например, литий является металлом, который является наименее плотным из всех элементов. Во-вторых, они имеют низкую температуру плавления и кипения. Калий, натрий и литий могут плавиться или кипеть уже при небольшом нагревании. В-третьих, они очень реактивны и легко взаимодействуют с водой и кислородом воздуха. Это проявляется в их яркой горючей способности, когда они выделяют пламя и образуют оксиды.
Какие свойства делают щелочные металлы опасными?
Щелочные металлы могут быть опасными из-за своей химической реактивности. Например, они могут взорваться при столкновении с водой или взаимодействии с кислородом воздуха. При этой реакции могут выделяться вспышка, пламя и газы, которые могут быть ядовитыми или взрывоопасными. Кроме того, щелочные металлы могут вызывать ожоги при контакте с кожей, так как они реагируют с ее влагой.
Какие еще элементы относятся к щелочным металлам?
Кроме лития (Li), натрия (Na) и калия (K), к щелочным металлам относятся также рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы находятся в первой группе периодической системы и обладают сходными свойствами. Щелочные металлы образуют наиболее активные щелочные ионы, имеют низкую электроотрицательность и легко отдают электроны в химических реакциях.
Для чего используются щелочные металлы в промышленности?
Щелочные металлы имеют множество применений в промышленности. Например, натрий используется при производстве мыла, стекла и щелочей. Калий применяется в удобрениях, подавителях пламени и при изготовлении сольвента для пищевой промышленности. Литий применяется в производстве литиевых батарей, а также в фармацевтической и химической промышленности. Рубидий и цезий используются в научных исследованиях, в особенности в оптике и электронике.
