Щелочноземельные металлы – это группа химических элементов, которые расположены во второй группе периодической таблицы. К ним относятся бериллий, магний, кальций, стронций, барий и радий. Эти металлы имеют много общих физических свойств, которые определяют их уникальную природу и широкое использование в различных сферах научных и промышленных исследований.
Первое общее свойство щелочноземельных металлов – это их низкая плотность. Бериллий является самым легким щелочноземельным металлом, а его плотность составляет всего 1,85 г/см³, в то время как плотность радия, самого тяжелого металла в этой группе, составляет 5 г/см³. Такая низкая плотность обусловлена относительно большими расстояниями между атомами металла и их простой кристаллической структурой.
Второе общее свойство щелочноземельных металлов – это низкая температура плавления. У всех металлов из этой группы точка плавления существенно ниже, чем у большинства других металлов. Например, точка плавления магния составляет всего 650°C, в то время как большинство других металлов имеют точку плавления свыше 1000°C. Это свойство позволяет использовать щелочноземельные металлы в различных отраслях промышленности, включая производство литейных сплавов.
Третье общее свойство щелочноземельных металлов – это высокая электропроводность. Все металлы этой группы обладают высокой электропроводностью, что означает, что они отлично проводят электрический ток. Это свойство делает щелочноземельные металлы незаменимыми для использования в электротехнике и электронике. Они широко применяются в производстве проводов, контактов и других элементов, где требуется эффективное проведение электрического тока.
Обобщая, щелочноземельные металлы обладают рядом общих физических свойств, которые определяют их особую природу и ценность. Низкая плотность, низкая температура плавления и высокая электропроводность делают их незаменимыми во многих отраслях научных и производственных исследований. Благодаря своим уникальным свойствам, щелочноземельные металлы востребованы во многих сферах, включая электротехнику, металлургию, электронику и многие другие.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они отличаются своими физическими свойствами, которые делают их полезными во многих отраслях научно-технического прогресса.
Одним из важнейших физических свойств щелочноземельных металлов является их низкая плотность. Например, бериллий и магний имеют плотность, в несколько раз меньшую, чем у стали. Это делает их легкими и прочными материалами, их используют в авиакосмической промышленности для создания легких и прочных конструкций.
Щелочноземельные металлы также обладают высокой теплопроводностью. Они отлично проводят тепло, что позволяет использовать их для создания материалов, способных эффективно передавать и отводить тепло. Например, магниевые сплавы часто используются в автомобильной и аэрокосмической промышленности, так как они отлично справляются с диссипацией тепла.
Ещё одним важным физическим свойством этих металлов является их химическая инертность. Они обладают высокой устойчивостью к коррозии и окислению, что делает их применяемыми в химической промышленности и в медицине. Кальций, к примеру, используется в производстве антацидов, а стронций и барий используются в радиологии для получения рентгеновской и гамма-лучевой диагностики.
Один из самых известных характерных свойств щелочноземельных металлов - способность образовывать сильные соединения с кислородом. Они легко реагируют с водой, выделяя водород и образуя гидроксиды. Например, магний реагирует с водой, выделяя водород и образуя гидроксид магния, что делает его полезным в производстве воспламеняющих взрывчатых смесей.
Выводящиеся свойства щелочноземельных металлов говорят о их уникальных характеристиках и широком спектре применения. Их низкая плотность, высокая теплопроводность, химическая инертность и способность образовывать сильные соединения делают эти металлы важными материалами в различных областях науки и техники.
Общая характеристика

Щелочноземельные металлы представляют собой группу элементов периодической таблицы, которые находятся во второй группе. К ним относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основные физические свойства щелочноземельных металлов связаны с их атомной структурой и валентностью. Атомы этих элементов имеют два внешних электрона, что делает их активными металлами с высокой химической реактивностью.
Щелочноземельные металлы имеют серебристо-белый цвет и мягкую текстуру. Они хорошо проводят электричество и тепло. У них низкая плотность и точка плавления. Бериллий является исключением из этой группы, так как он обладает особыми свойствами: бериллий является тугоплавким и обладает высокой твердостью.
Щелочноземельные металлы растворяются в воде, образуя гидроксиды, которые обладают щелочными свойствами. Они реагируют с кислородом, образуя оксиды металлов. Щелочноземельные металлы имеют высокую активность и способны образовывать соединения с различными элементами.
Электронная конфигурация щелочноземельных металлов

Электронная конфигурация щелочноземельных металлов характеризуется особенной расположенностью электронов в энергетических оболочках атомов данных элементов.
Щелочноземельные металлы относятся к II группе периодической системы и состоят из следующих элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Каждый из этих элементов имеет свою уникальную электронную конфигурацию.
Например, бериллий имеет атом с электронной конфигурацией 1s2 2s2. Это означает, что в первой оболочке атома бериллия находятся 2 электрона, а во второй оболочке - еще 2 электрона. Всего у атома бериллия 4 электрона.
Продолжая пример, атом магния имеет электронную конфигурацию 1s2 2s2 2p6 3s2. Здесь в первой оболочке находятся 2 электрона, во второй - 8 электронов, а в третьей - 2 электрона. Всего у атома магния 12 электронов.
Таким образом, электронная конфигурация щелочноземельных металлов раскрывает расположение электронов в атомах и помогает понять и объяснить их основные физические свойства.
Температура плавления и кипения щелочноземельных металлов
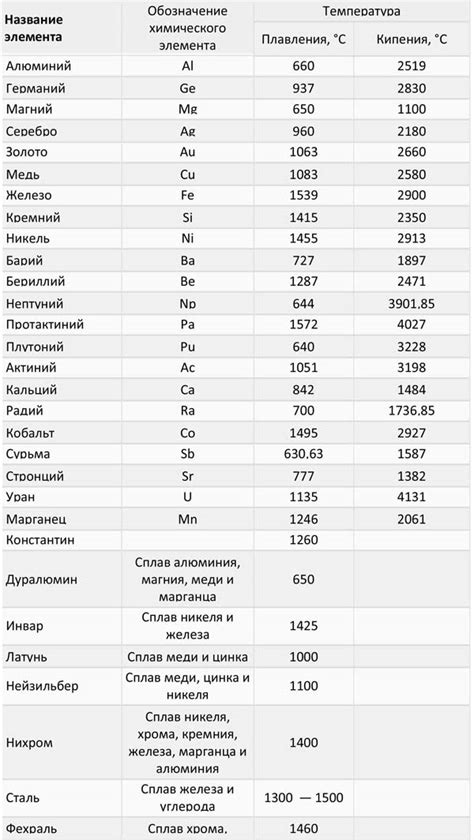
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают различными значениями температуры плавления и кипения.
Наиболее низкую температуру плавления среди щелочноземельных металлов имеет бериллий. Его плавление происходит при температуре около 1278 градусов Цельсия. Затем следуют магний, кальций, стронций и барий, с плавлением при температурах около 650, 842, 769 и 727 градусов Цельсия соответственно.
Кипение щелочноземельных металлов происходит при гораздо более высоких температурах. Например, магний кипит при температуре около 1090 градусов Цельсия, кальций - около 1484, стронций - около 1655, а барий - около 2170 градусов Цельсия.
Однако, следует отметить, что радий, который является самым тяжелым и радиоактивным из щелочноземельных металлов, имеет очень низкую температуру плавления и кипения. Его плавление происходит при температуре около 700 градусов Цельсия, а кипение - только при 1737 градусах Цельсия.
Плотность щелочноземельных металлов

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, отличаются относительно высокой плотностью. Плотность указывает на массу вещества, содержащуюся в единице объёма.
Бериллий, самый лёгкий из щелочноземельных металлов, имеет плотность около 1,85 г/см³. В результате своей низкой плотности, бериллий является одним из самых лёгких структурных металлов, что делает его ценным материалом для создания лёгких и прочных конструкций.
Магний, следующий по плотности щелочноземельный металл, имеет плотность около 1,74 г/см³. Этот металл широко используется в авиационной и автомобильной промышленности благодаря своей лёгкости и прочности.
Кальций, стронций и барий имеют плотность около 1,55 г/см³, 2,54 г/см³ и 3,5 г/см³ соответственно. Высокая плотность этих металлов делает их полезными в различных отраслях, включая строительство, металллургию и электронику.
Радий, самый плотный из щелочноземельных металлов, обладает плотностью около 5,5 г/см³. Этот радиоактивный элемент, известный своим радиоактивным распадом, очень редкий и тяжёлый. Радий находит применение в научных и медицинских исследованиях, а также в промышленности, например, в производстве светоиспускающих материалов.
Твердость и механические свойства щелочноземельных металлов

Щелочноземельные металлы обладают определенными свойствами твердости и механической прочности, которые определяют их использование в различных отраслях промышленности и научных исследованиях.
Твердость щелочноземельных металлов характеризуется их способностью противостоять деформации под воздействием внешних сил. Это свойство является результатом кристаллической структуры металлов, которая обеспечивает высокую степень сжатия и плотность атомов.
Самым твердым щелочноземельным металлом является бериллий, обладающий высоким значением твердости по шкале Виккерса. Он обладает исключительно высокой устойчивостью к механическим воздействиям, что делает его востребованным материалом в аэрокосмической, авиационной и других отраслях, где требуется высокая прочность и устойчивость к износу.
Остальные щелочноземельные металлы, такие как магний, кальций, стронций и барий, также обладают высокой твердостью, но уступают по этому показателю бериллию. Однако они все равно находят применение в промышленности, например, в производстве сплавов и конструкционных материалов.
Электропроводность и теплопроводность щелочноземельных металлов
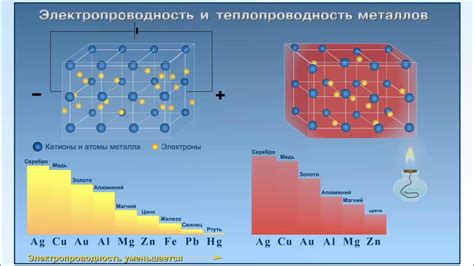
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают хорошей электропроводностью и теплопроводностью.
Электропроводность щелочноземельных металлов связана с их способностью легко отдавать электроны. В кристаллической решетке щелочноземельных металлов электроны находятся в общей зоне проводимости, что обеспечивает хорошую электропроводность.
Теплопроводность щелочноземельных металлов обусловлена высокой подвижностью электронов и ионов в их кристаллической решетке. Это позволяет энергии передвигаться эффективно и быстро, что способствует высокой теплопроводности.
Для щелочноземельных металлов характерно также то, что их электропроводность и теплопроводность растет с увеличением температуры. Это связано с увеличением амплитуды колебаний атомов в решетке, что облегчает перемещение зарядов и тепловой энергии.
В целом, электропроводность и теплопроводность щелочноземельных металлов обусловлены особенностями их кристаллической структуры и взаимодействий между атомами и ионами в решетке. Эти свойства делают щелочноземельные металлы важными материалами для различных технических и промышленных приложений.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы – это группа элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Каждый из этих металлов обладает своими химическими свойствами, которые определяются их электронной структурой и положением в периодической системе.
Одной из основных химических свойств щелочноземельных металлов является их способность образовывать оксиды. Металлы этой группы реагируют с кислородом воздуха, образуя оксиды, которые обладают щелочными свойствами. Например, магний с горением образует оксид магния (MgO), который является основанием и обладает щелочными свойствами.
Другим важным химическим свойством щелочноземельных металлов является их реакционная способность со водой. Например, кальций при взаимодействии с водой выделяет гидроксид кальция (Ca(OH)2) и высвобождает водород. Реакция металлов этой группы с водой обычно происходит с образованием гидроксидов и выделением водорода.
Еще одним важным химическим свойством щелочноземельных металлов является их способность образовывать соединения с другими элементами. Например, бериллий образует соединения с кислородом, серой, азотом и другими элементами. Также магний образует соединения с азотом, фосфором, серой и другими неметаллами.
Щелочноземельные металлы также обладают способностью образовывать растворимые соли. Бериллий, кальций, стронций и барий образуют растворимые соли с различными кислотами. Магний, поскольку он обладает небольшим размером и большой полярностью ионов, образует малорастворимые или нерастворимые соли.
Таким образом, химические свойства щелочноземельных металлов проявляются в их способности образовывать оксиды, реагировать со водой, образовывать соединения с другими элементами и образовывать растворимые соли.
Вопрос-ответ

Какие физические свойства характерны для щелочноземельных металлов?
Щелочноземельные металлы обладают рядом характерных физических свойств. Они являются мягкими и легкими металлами, обладают низкой плотностью и низкой температурой плавления. Они ярко горят при взаимодействии с кислородом, образуя оксиды. Кроме того, щелочноземельные металлы имеют низкую теплоемкость и теплопроводность, а также высокую электропроводность.
Какое значение имеет низкая плотность у щелочноземельных металлов?
Низкая плотность щелочноземельных металлов (например, бериллия, магния) позволяет им быть легкими и мягкими материалами. Благодаря этому, они могут использоваться в различных сферах, включая авиацию, аэрокосмическую промышленность, производство сплавов, а также в медицинской промышленности.
Почему щелочноземельные металлы горят при взаимодействии с кислородом?
Щелочноземельные металлы горят при взаимодействии с кислородом из-за их высокой реакционной способности. При соприкосновении с воздухом или кислородом, щелочноземельные металлы начинают окисляться, при этом выделяется большое количество тепла и образуются соответствующие оксиды.
Какие еще свойства отличают щелочноземельные металлы?
Помимо описанных выше характеристик, щелочноземельные металлы имеют низкую теплоемкость и теплопроводность. Это означает, что они плохо сохраняют тепло и плохо его проводят. Кроме того, эти металлы обладают высокой электропроводностью, что делает их полезными в электротехнических приложениях.
