Металлы являются важным классом материалов, которые широко используются в различных отраслях промышленности и науки. Одной из ключевых особенностей металлов является их способность образовывать химические связи, которые оказывают значительное влияние на их физические свойства.
Химическая связь между атомами металла обусловлена обменом электронами, что позволяет атомам образовывать кристаллическую решетку. Эта решетка обеспечивает металлам такие свойства, как высокая теплопроводность и электропроводность. Кроме того, химическая связь между атомами металла обусловливает их способность к деформации и пластичности. Благодаря этому, металлы могут быть легко подвергнуты обработке и использоваться в процессах литья и ковки.
Однако, тип химической связи и его сила могут варьироваться в зависимости от конкретного металла и его состава. Например, некоторые металлы образуют ионные связи, при которых атомы металла отдают или принимают электроны. Другие металлы образуют ковалентные связи, при которых электроны обмениваются между атомами. Также существуют металлы, которые образуют металлическую связь, при которой электроны свободно перемещаются по всей решетке металла.
Все эти различия в типах химических связей между атомами металла влияют на их физические свойства. Например, металлы с ионной связью обладают высокой температурой плавления и кипения, а также низкой твердостью. Металлы с ковалентной связью могут быть очень твердыми и иметь высокую точку плавления. А металлы с металлической связью обладают хорошей термической и электрической проводимостью.
Таким образом, понимание влияния химической связи на физические свойства металлов позволяет улучшить их использование на практике, разрабатывать новые сплавы и материалы с оптимальными свойствами. Также, изучение химической связи в металлах является важным вопросом в области физической химии и материаловедения, что способствует развитию науки и технологий.
Структура металлов и ее влияние на свойства

Структура металлов определяется характером и свойствами их кристаллической решетки. Кристаллическая решетка металлов включает в себя металлические ионные решетки с положительными металлическими ионами и электронами, которые свободно двигаются внутри решетки.
Металлические связи в кристаллической решетке обладают сильными ковалентными характеристиками, что обуславливает высокую пластичность и теплопроводность металлов. Ковалентные связи обеспечивают высокую прочность и упругость металлов.
Влияние структуры металлов на их свойства является основным фактором, определяющим их физические и химические свойства. Например, кристаллические металлы обладают высокой пластичностью и могут быть легко деформированы без разрушения структуры. Это свойство делает металлы отличными материалами для использования в промышленности, так как они могут быть легко обработаны и формированы в различные продукты.
Кроме того, структура металлов влияет на их электропроводность. Свободные электроны, находящиеся в решетке, ответственны за проводимость электрического тока через металл. Большое количество свободных электронов позволяет металлам быть хорошими проводниками.
В целом, структура металлов играет ключевую роль в определении их свойств. Кристаллическая решетка, связи между атомами и свободные электроны влияют на пластичность, прочность, упругость и проводимость металлов.
Межатомные связи и их роль в формировании свойств металлов

Межатомные связи в металлах играют важную роль в формировании их физических свойств. Они обеспечивают структурную устойчивость металлов и определяют их химические и физические свойства.
В металлах присутствуют несколько типов межатомных связей. Одним из наиболее распространенных является металлическая связь. В этом типе связи свободные электроны, находящиеся в валентной зоне металла, образуют общую электронную оболочку для всех атомов металла. Такая связь обладает высокой прочностью, что позволяет металлам обладать хорошей пластичностью и проводимостью электричества и тепла.
Кроме металлической связи, в металлах могут присутствовать ионные связи между положительно и отрицательно заряженными ионами. Электроны в этом случае переходят с атомов металла на атомы других элементов, образуя ионы разного заряда. Ионные связи влияют на твердость и плавление металлов, а также на их способность образовывать соединения с другими веществами.
Комплексные металлы содержат также координационные связи, которые образуются между металлом и лигандами, такими как атомы или группы атомов, обладающие несвязанными электронными парами. Координационные связи определяют структуры и свойства комплексных металлов, такие как их цветность и способность каталитических реакций.
Таким образом, межатомные связи играют ключевую роль в формировании свойств металлов. Металлическая связь обеспечивает пластичность и проводимость, ионная связь влияет на твердость и способность соединяться, а координационные связи определяют структуры и цветность комплексных металлов.
Кристаллическая решетка и связь с физическими свойствами
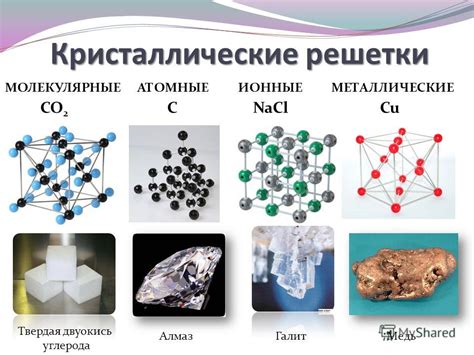
Кристаллическая решетка металлов - это упорядоченная структура, которая образуется благодаря взаимодействию химических связей между атомами. Эта решетка имеет определенные размеры, форму и симметрию. Она является основой для формирования физических свойств металлов.
Взаимодействие атомов в кристаллической решетке определяет такие физические свойства металлов, как их механическая прочность и пластичность. Химическая связь между атомами обеспечивает устойчивость решетки и позволяет металлам выдерживать большие нагрузки без разрушения. Кристаллическая решетка также обеспечивает пластичность, позволяя атомам перемещаться относительно друг друга при деформации материала.
Кристаллическая решетка также оказывает влияние на электрические и тепловые свойства металлов. Регулярное расположение атомов в решетке способствует передаче электрического тока и тепла. Благодаря этому металлы обладают высокой электропроводностью и теплопроводностью.
Кристаллическая решетка также влияет на оптические свойства металлов. Например, благодаря решетке металлы могут поглощать и отражать свет, что позволяет им иметь определенный цвет или блеск.
Таким образом, кристаллическая решетка обеспечивает металлам уникальные физические свойства, которые делают их незаменимыми в различных областях жизни и промышленности.
Электронная структура и ее влияние на теплопроводность металлов

Теплопроводность - важное физическое свойство металлов, которое определяет их способность эффективно передавать тепло. Одним из основных факторов, влияющих на теплопроводность, является электронная структура металла.
Металлы обладают свободными электронами, которые образуют так называемую электронную оболочку. Эти свободные электроны перемещаются между атомами металла и создают так называемую "электронную газ" или "электронное облако".
Именно эти свободные электроны играют ключевую роль в теплопроводности металлов. Они могут передавать энергию от одного атома к другому, внося вклад в процесс проводимости тепла.
Электронная структура металла определяет количество свободных электронов и их энергетическое состояние. Чем больше свободных электронов имеет металл и чем меньше различий в их энергии, тем лучше металл будет проводить тепло.
Также важно отметить, что теплопроводность металлов может зависеть от структуры кристаллической решетки. Например, в кристаллической структуре металла могут иметься дефекты, такие как примеси или дислокации, которые могут снижать теплопроводность.
Итак, электронная структура и структура кристаллической решетки металлов - два основных фактора, влияющих на их теплопроводность. Понимание этих связей позволяет улучшить технологии теплопередачи и создать материалы с повышенной теплопроводностью для различных применений.
Влияние химической связи на пластичность и прочность металлов

Пластичность и прочность - две основные физические свойства металлов, которые определяют их возможности и применение. Пластичность металлов характеризуется их способностью деформироваться без разрушения, а прочность - способностью выдерживать напряжения без разрушения.
Химическая связь в металлах и их кристаллическая структура оказывают существенное влияние на эти свойства. Металлы образуют кристаллическую решетку, в которой атомы связаны друг с другом металлической связью. Эта связь обладает специфическими свойствами, такими как высокая механическая прочность и пластичность.
Однако связь между атомами в металлах не является абсолютно прочной и может прерываться в результате различных воздействий, например, при деформации металла. В этом случае происходит смещение атомов и изменение кристаллической структуры металла. Чем выше степень смещения атомов и деформация кристалла, тем более пластичным является металл.
При этом, прочность металла напрямую зависит от величины и качества химической связи в металлической решетке. Чем крепче связь между атомами, тем выше прочность металла. Внутри металлической решетки могут образовываться некоторые дефекты, такие как вакансии, трещины или границы зерен, которые ослабляют связь и снижают прочность металла.
Таким образом, пластичность и прочность металлов определяются сочетанием механических свойств металлической связи и кристаллической структуры металла. Понимание и контроль этих факторов позволяет разрабатывать металлические материалы с оптимальными пластическими и прочностными характеристиками для различных применений.
Влияние химической связи на плотность и твердость металлов

Химическая связь играет важную роль в определении физических свойств металлов, включая их плотность и твердость. Плотность металла зависит от химической связи между его атомами и определяется их массой и расстоянием между ними. Чем более крепкая химическая связь, тем плотнее структура металла и выше его плотность.
Твердость металла, в свою очередь, зависит от силы химической связи и способности атомов металла сопротивляться деформации. Сильная химическая связь обеспечивает металлу высокую твердость, так как атомы не могут легко двигаться относительно друг друга. Например, металлы с ковалентной связью, такие как графит, обладают низкой твердостью, в то время как металлы с металлической связью, такие как железо, имеют высокую твердость.
Влияние химической связи на плотность и твердость металлов может быть объяснено на молекулярном уровне. В металлической связи, электроны образуют общую оболочку и могут свободно двигаться по всему металлу. Это создает сильные и прочные связи между атомами, что обеспечивает высокую плотность и твердость металла. В то время как в ковалентной или ионной связи, атомы имеют более строго определенные позиции и ограниченную подвижность, что приводит к более низкой плотности и твердости.
Таким образом, химическая связь между атомами металлов является ключевым фактором, определяющим их плотность и твердость. Различные типы связей, такие как металлическая, ковалентная и ионная, обладают различной прочностью, что влияет на физические свойства металлов. Понимание этого влияния помогает нам лучше понять и объяснить поведение металлов в различных условиях и использовать их в промышленности и научных исследованиях.
Влияние химической связи на электрические свойства металлов

Электрические свойства металлов определяют их способность проводить электрический ток. Важными характеристиками металлов в этом отношении являются электрическая проводимость и электропроводность. Однако эти свойства напрямую зависят от особенностей химической связи между атомами металла.
Основной тип химической связи в металлах - это металлическая связь. В металлической связи свободные электроны образуют электронное облако, которое перемещается по кристаллической решетке металла. Именно благодаря этому облаку металлы обладают высокой электропроводностью.
Химическая связь металлов также влияет на их способность отдавать или принимать электроны, что связано с явлением электроотрицательности. Металлы отдают электроны и образуют положительно заряженные ионы, которыми привлекают отрицательно заряженные электроны металлической связи. Этот процесс позволяет металлам участвовать в химических реакциях и образовывать ионные соединения.
Различные металлические связи определяют электрические свойства металлов. Например, присутствие примесей в металлической решетке может понижать электропроводность из-за возникновения дефектов в кристаллической структуре. Также металлическая связь может быть ослаблена при повышении температуры или давления, что приводит к ухудшению электрических свойств металлов.
Таким образом, химическая связь играет важную роль в определении электрических свойств металлов. Она определяет электропроводность и способность металлов участвовать в химических реакциях, а также может быть подвержена внешним воздействиям, влияющим на электрические свойства металлов.
Вопрос-ответ

Какая химическая связь присутствует в металлах?
В металлах преобладает так называемая металлическая связь. Это особый тип химической связи, который образуется между положительно заряженными ионами металла (катионами) и общими электронами, которые образуют электронное облако.
Какая роль химической связи влияет на физические свойства металлов?
Химическая связь в металлах определяет их физические свойства. Металлическая связь, характеризующаяся высокой проводимостью электричества и тепла, влияет на электропроводность металлов, их пластичность и тугоплавкость. Кроме того, химическая связь в металлах обеспечивает им высокую степень механической прочности и устойчивость к коррозии.
Какие физические свойства металлов зависят от химической связи?
Химическая связь в металлах влияет на их электропроводность, теплопроводность и магнитные свойства. Также химическая связь определяет пластичность металлов, их способность изменять форму без разрушения. Более того, химическая связь обуславливает устойчивость металлов к коррозии и степень их механической прочности.
