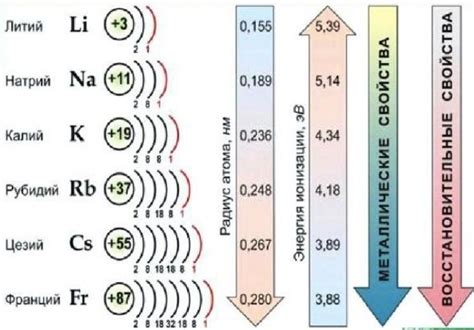
Щелочные металлы - это элементы, относящиеся к первой группе периодической таблицы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Физические свойства щелочных металлов определяют их особенности в веществе и состоянии, а химические свойства позволяют нам понять их активность и реакционную способность.
Физические свойства щелочных металлов включают низкую плотность, низкую температуру плавления и кипения, а также мягкую текстуру. Щелочные металлы обладают серебристо-белым цветом и высокой проводимостью электричества и тепла. Они очень реактивны и могут легко окисляться и растворяться в воде. Кроме того, щелочные металлы имеют низкую твердость и могут быть нарезаны ножом.
Химические свойства щелочных металлов связаны с их высокой активностью и способностью образовывать оксиды и гидроксиды. Вода реагирует с щелочными металлами, образуя щелочные гидроксиды и выделяя водород. Они также реагируют с кислородом, образуя оксиды металлов. Щелочные металлы обладают высокой аффинностью к кислороду и могут легко образовывать соединения с другими элементами.
Щелочные металлы имеют широкое применение в различных областях. Например, литий широко используется в аккумуляторах, а натрий используется в производстве стекла и водоочистке. Калий применяется в сельском хозяйстве в качестве удобрения, а рубидий и цезий находят применение в научных исследованиях и в производстве оптических приборов. Франций, самый редкий и радиоактивный щелочный металл, имеет ограниченное применение из-за своей высокой степени радиоактивности.
Физические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы, являющиеся самыми активными металлами. Они обладают рядом уникальных физических свойств, которые делают их полезными и широко применяемыми в различных областях.
Первое значимое свойство щелочных металлов - это низкая плотность. Они являются легкими металлами, что делает их удобными для использования в промышленности и технике. Калий, натрий и литий, например, обладают плотностью меньше, чем у большинства других металлов, что делает их легкими для перевозки и обработки.
Второе важное свойство щелочных металлов - это низкая температура плавления. Все щелочные металлы обладают очень низкими температурами плавления, что позволяет им быть использованными в различных процессах, требующих высоких температур. Во время плавления, щелочные металлы образуют мягкую и гладкую поверхность, что делает их идеальными для использования в процессе покрытия или пайки.
Третье свойство щелочных металлов - их отличная электропроводность. Щелочные металлы обладают высокой электропроводностью, что делает их идеальными для использования в проводниках и электрических контактах. Натрий и калий, например, широко используются в электронике и электрических устройствах.
И, наконец, очень важное свойство щелочных металлов - их реактивность с водой. Видимо, это самое известное и опасное свойство, связанное с щелочными металлами. Когда щелочные металлы взаимодействуют с водой, они образуют щелочную растворимую в воде основу. Это реактивное свойство делает щелочные металлы полезными в области химической промышленности, особенно в процессе производства щелочей и других химических соединений.
Плотность, температура плавления и кипения
Щелочные металлы, такие как литий, натрий, калий и другие, обладают особыми физическими свойствами, включая высокую плотность, низкую температуру плавления и высокую температуру кипения.
Плотность щелочных металлов составляет приблизительно от 0.53 г/см³ (литий) до 0.97 г/см³ (цезий), что делает их одной из самых плотных групп элементов. Это позволяет использовать их в различных областях, включая производство легких конструкций и батарей.
Температура плавления щелочных металлов также относительно низкая. Например, калий плавится при температуре около 63 °C, в то время как натрий плавится при 97.8 °C. Это делает их непригодными для использования в очень высоких температурах, но их низкая температура плавления позволяет легко перерабатывать их и использовать в различных производственных процессах.
Температура кипения щелочных металлов также достаточно высока. Например, литий кипит при температуре около 1342 °C, а цезий кипит при температуре около 678 °C. Благодаря этим высоким значениям щелочные металлы остаются в жидком состоянии при повышенных температурах, что позволяет использовать их в различных промышленных процессах, таких как выработка энергии и производство сплавов.
Химические свойства щелочных металлов

Щелочные металлы - группа элементов, которые помимо общих физических свойств также обладают рядом химических свойств, вытекающих из их электронной конфигурации и положения в периодической системе.
Первым характерным свойством щелочных металлов является их высокая реакционная способность. Они очень активно взаимодействуют с водой, кислородом, строительными материалами и многими другими веществами.
Щелочные металлы легко реагируют с водой, при этом образуется щелочная растворимая основа и выделяется водород. Например, натрий (Na) реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород (H2).
Другим химическим свойством щелочных металлов является образование ионов с положительным зарядом. Щелочные металлы имеют одну валентную электрону и легко отдают ее при реакциях, образуя ионы с единичным положительным зарядом. Например, ион натрия имеет заряд +1 (Na+).
Щелочные металлы также проявляют способность образовывать соединения с кислородом, причем в большинстве своем вещества этих соединений являются кислородсодержащими солями. Например, перманганат калия (KMnO4), где калий (K) является щелочным металлом.
Реакция с водой

Щелочные металлы, такие как литий, натрий и калий, проявляют активную реакцию при контакте с водой.
Вода реагирует с щелочными металлами, образуя гидроксид металла и выделяя водород. Этот процесс иллюстрирует их высокую химическую реактивность. Реакция с водой протекает очень быстро, и энергия выделяется в виде высокой температуры, пламени и пузырьков.
Например, при реакции калия с водой образуется гидроксид калия (каустическая сода) и выделяется водород. Реакция может быть представлена следующим уравнением:
2K + 2H2O → 2KOH + H2
Эта реакция является очень быстрой и экзотермической, то есть сопровождается выделением значительного количества тепла.
Такая реакция щелочных металлов с водой может использоваться в промышленности для получения водорода или при проведении химических экспериментов в лабораториях. Также вода является одним из способов тушения пожара, в случае если огонь возникнет из-за реакции с щелочными металлами.
Реакция с кислородом

Щелочные металлы, такие как литий, натрий, калий, имеют сильную реакцию с кислородом. При контакте с кислородом, они сгорают, образуя оксиды, которые являются щелочными. Например, натрий сгорает в кислороде с ярким пламенем, образуя оксид натрия (Na2O).
Реакция с кислородом особенно интенсивна при нагревании. При этом образуется взрывоопасный продукт - пероксид натрия (Na2O2). Пероксид натрия широко применяется в химической промышленности в качестве кислородосодержащего производного.
Благодаря своей реактивности с кислородом, щелочные металлы широко используются для создания различных веществ. Калий и его соединения, например, используются для производства удобрений. Калийные соединения вносятся в почву, чтобы обогатить ее питательными веществами и улучшить рост растений.
Кроме того, щелочные металлы используются для создания сильных оснований, таких как гидроксид натрия (NaOH), который применяется в химической промышленности, при производстве мыла и в бытовых хозяйствах, для регулирования pH и очистки поверхностей.
Реакция с кислотами

Щелочные металлы обладают высокой реакционной способностью с кислотами и водой. Реакция щелочных металлов с кислотами происходит с образованием соли и выделением водорода.
Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению молекул водорода:
2Na + 2HCl → 2NaCl + H2
Подобным образом реагирует и другой щелочной металл - калий:
2K + 2HCl → 2KCl + H2
Реакция сульфатов щелочных металлов с соляной кислотой приводит к образованию хлорида металла и выделению сероводорода:
Na2SO4 + 2HCl → 2NaCl + H2SO4
Кроме того, щелочные металлы способны реагировать с различными видами кислот, включая серную, азотную, фосфорную и другие. В результате таких реакций образуются соли и соответствующие продукты.
Применение щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), имеют широкое применение в различных сферах нашей жизни.
1. Бытовая техника и электроника: Щелочные металлы используются в производстве батареек и аккумуляторов благодаря своей высокой электрохимической активности. Они обеспечивают надежное и долговечное питание для различных устройств, таких как наручные часы, пульты дистанционного управления, компьютеры и многое другое.
2. Медицина: Щелочные металлы применяются в медицинских аппаратах, таких как электрокардиографы и электроэнцефалограммы, для обеспечения надежной работы и точности измерений. Они также используются для изготовления различных медицинских препаратов и примесей для обработки и дезинфекции.
3. Промышленность: Щелочные металлы используются в различных отраслях промышленности. Например, натрий используется при производстве стекла и мыла, а калий - в производстве удобрений. Некоторые щелочные металлы также используются в процессе обработки металлов и газов, а также в качестве катализаторов в химической промышленности.
4. Энергетика: Щелочные металлы и их соединения используются в производстве солнечных батарей и топливных элементов. Они способны генерировать электричество из солнечного излучения или реакции между водородом и кислородом. Также щелочные металлы используются в качестве теплоносителей и рабочих жидкостей в некоторых типах тепловых энергетических установок.
В целом, щелочные металлы оказывают значительное влияние на нашу современную жизнь благодаря своим уникальным свойствам и широкому спектру применения в различных отраслях. Их использование продолжает развиваться и находить новые области применения в научных и технологических исследованиях.
Использование в производстве сплавов

Щелочные металлы, такие как литий, натрий, калий и рубидий, широко используются в промышленности для производства различных сплавов. Их уникальные химические и физические свойства делают их незаменимыми компонентами во многих отраслях производства.
Одним из наиболее распространенных применений щелочных металлов в производстве сплавов является процесс легирования. Легирование – это добавление малых количеств металлических элементов к основному металлу для улучшения его свойств. Щелочные металлы часто используются в качестве легирующих элементов благодаря их способности улучшать механические и физические свойства сплавов.
Сплавы на основе щелочных металлов могут обладать высокой прочностью, устойчивостью к коррозии, низкой плотностью и другими полезными свойствами, делая их идеальными для использования в различных отраслях. Они широко используются в авиационной, автомобильной, электронной, судостроительной и нефтегазовой промышленности.
Благодаря высокой электропроводимости щелочные металлы также часто используются в производстве электрических проводов и кабелей, а также в электронной промышленности для создания полупроводниковых компонентов. Их низкая плотность и способность реагировать с кислородом делают их идеальными для использования в легких материалах, таких как алюминий и магний, используемых в авиационной и автомобильной промышленности.
Использование щелочных металлов в медицине
Щелочные металлы, такие как литий, натрий, калий и рубидий, имеют различные физические и химические свойства, которые находят применение в медицине. Их медицинское использование обусловлено способностью взаимодействовать с организмом и оказывать на него положительное влияние.
Литий является одним из наиболее известных щелочных металлов, используемых в медицине. Его соединения, такие как литийкарбонат, применяются для лечения биполярного аффективного расстройства и депрессии. Литий уравновешивает нейрохимические процессы в мозге и помогает контролировать эмоциональное состояние пациентов.
Натрий и калий являются важными микроэлементами, необходимыми для нормального функционирования организма. Натрий участвует в регуляции давления, водного баланса и нервных импульсов, а калий необходим для работы сердечно-сосудистой системы, мышц и нормализации электролитного баланса. Препараты, содержащие натрий и калий, широко применяются в медицине для коррекции электролитного баланса и лечения различных состояний, связанных с недостатком или нарушением обмена этих элементов.
В некоторых случаях, рубидий может использоваться в качестве «радиоактивной метки» при проведении диагностических исследований. Сочетание радиоизотопа рубидия и других веществ позволяет получить детальные изображения органов и тканей с помощью специальных методов изображения, таких как ПЭТ-скан.
Таким образом, использование щелочных металлов в медицине позволяет эффективно лечить различные заболевания, поддерживать нормальное физиологическое состояние организма и проводить диагностические исследования для выявления патологий.
Вопрос-ответ

Какими свойствами отличаются щелочные металлы?
Щелочные металлы имеют ряд особенных свойств: они являются мягкими и низкоплавкими, обладают низкой плотностью, образуют гидроксиды и оксиды, которые растворимы в воде, и реагируют с кислородом и водой.
Какие применения имеют щелочные металлы?
Щелочные металлы широко используются в различных отраслях промышленности. Например, их соединения применяются в производстве стёкол, мыла, моющих средств, а также в литейной промышленности, в процессе производства аккумуляторов и атомных реакторов. Калий применяется в сельском хозяйстве в качестве удобрения, а литий используется в производстве аккумуляторов и лекарственных препаратов.
Какие химические реакции происходят с щелочными металлами?
Щелочные металлы активно взаимодействуют с водой, выделяя водород и образуя щелочные гидроксиды. Они также реагируют с кислородом, образуя оксиды. Кроме того, щелочные металлы могут взаимодействовать с другими веществами, образуя различные соединения.
