Энергия ионизации щелочных металлов является одной из важных характеристик, определяющих химические свойства этих элементов. Щелочные металлы включают в себя литий, натрий, калий, рубидий, цезий и франций, и они находятся в первой группе периодической таблицы. Каждый из этих элементов обладает уникальными свойствами и химической реактивностью, которые в значительной степени зависят от их энергии ионизации.
Энергия ионизации (IE) щелочных металлов определяет энергию, необходимую для удаления электрона из атома этого элемента в его нейтральном состоянии. Чем выше энергия ионизации, тем сильнее электрон удерживается атомом. Этот параметр позволяет оценить степень стабильности и реактивности элемента. Кроме того, энергия ионизации также связана с размером ионного радиуса, атомной электронной структурой и теплоотдачей щелочных металлов.
В таблице периодических элементов энергия ионизации щелочных металлов увеличивается по мере движения слева направо в периоде и уменьшается по мере движения сверху вниз по группе. Наименьшей энергией ионизации обладает франций, самый тяжелый и редкий щелочный металл, а наибольшей — литий, наиболее легкий элемент в этой группе. Важно отметить, что энергия ионизации щелочных металлов имеет обратную зависимость с их реактивностью: чем меньше энергия ионизации, тем более реактивен элемент.
Что такое энергия ионизации?
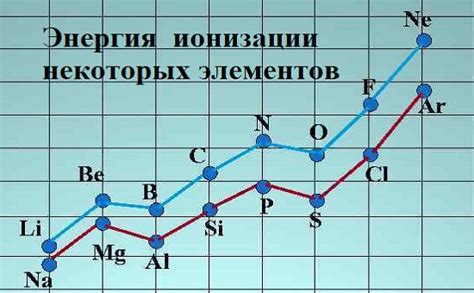
Энергия ионизации - это энергия, которая требуется для удаления электрона из атома или иона. Эта энергия измеряется в электрон-вольтах (эВ) и является мерой стабильности атома или иона. Чем выше энергия ионизации, тем сильнее связь между электроном и атомом.
Щелочные металлы из группы 1 периодической системы имеют низкую энергию ионизации. Это означает, что они легко отдают электроны и образуют положительные ионы. Чаще всего в щелочных металлах электрон отдаётся из последнего энергетического уровня, так как внешний электрон находится на большем расстоянии от ядра и слабее связан с атомом.
Наиболее низкую энергию ионизации имеет франций (Fr) с энергией ионизации 3.9 эВ, а наибольшую - гелий (He) с энергией ионизации 24.6 эВ. Чтобы удалять электроны с атомов газообразных металлов, необходимо приложить существенные усилия, поэтому они практически не образуют ионы в обычных условиях.
Энергия ионизации щелочных металлов убывает с увеличением периода. Также энергия ионизации убывает с увеличением атомного радиуса щелочных металлов - чем больше атомная масса, тем ниже энергия ионизации.
Значение энергии ионизации для химических элементов

Энергия ионизации – это энергия, необходимая для отрыва электрона от атома в невозмущенном состоянии. Значение этой энергии является важным характеристикой элементов и позволяет определить их активность и химические свойства.
Для химических элементов характерны разные значения энергии ионизации. Они расположены в таблице Менделеева, где можно увидеть, что эта энергия увеличивается при движении отлевых сторон периодической системы к правым.
Наибольшая энергия ионизации наблюдается у элементов справа в верхней части таблицы, таких как газы инертные, гелий и неон. Это связано с тем, что у этих элементов заполнена последняя электронная оболочка иономорфного атома. Следовательно, требуется большая энергия, чтобы отрывать электроны от атомов этих элементов.
С другой стороны, энергия ионизации для щелочных металлов, таких как литий, натрий и калий, относительно низкая. Это объясняется тем, что эти элементы имеют один электрон в своей внешней электронной оболочке иономорфного атома, который легко отрывается.
Характеристика энергии ионизации помогает определить, какие элементы обладают большей склонностью образовывать катионы, а какие – меньшей. Она также влияет на химическую активность элементов и их способность образовывать соединения с другими веществами.
Таким образом, энергия ионизации является важной характеристикой химических элементов, определяющей их свойства и активность в химических реакциях.
Что представляет собой таблица ионизации щелочных металлов?
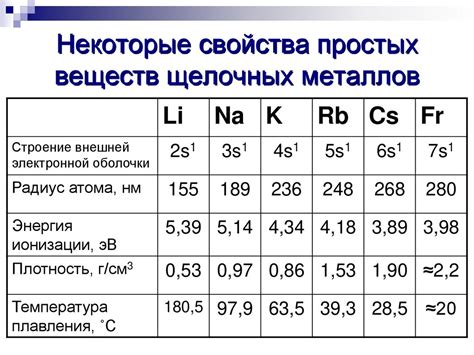
Таблица ионизации щелочных металлов представляет собой перечень данных о значениях энергии ионизации для элементов данной группы периодической системы. Щелочные металлы включают в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Энергия ионизации определяет энергию, необходимую для удаления одного электрона из нейтрального атома в его основном состоянии. Чем выше значение энергии ионизации, тем сильнее атом удерживает свои электроны и тем выше его степень ионизации.
Таблица ионизации щелочных металлов может быть представлена в виде упорядоченного списка, где каждый элемент группы указывается в порядке возрастания атомного номера. Также таблица может содержать числовые значения энергии ионизации для каждого элемента, а также дополнительные сведения, такие как электронная конфигурация и общие закономерности, относящиеся к ионизации данных элементов.
Изучение таблицы ионизации щелочных металлов позволяет уяснить, что значения энергии ионизации в данной группе имеют тенденцию к уменьшению сверху вниз. Также важно учесть, что энергия ионизации может зависеть от других факторов, таких как размер атома и его электронная конфигурация.
Какие щелочные металлы имеют высокую энергию ионизации?

В таблице щелочных металлов, составленной в химии, можно обнаружить несколько значений для энергии ионизации каждого из них. Энергия ионизации является мерой энергии, необходимой для удаления одного или нескольких электронов из атома щелочного металла. Чем выше значение энергии ионизации, тем большей энергии требуется для ионизации атома.
Среди щелочных металлов, литий (Li) и фтор (F) имеют наибольшую энергию ионизации. У лития энергия ионизации составляет около 520 кДж/моль, а у фтора она достигает 1681 кДж/моль. Эти значения объясняются следующим образом: литий имеет наименьший радиус и наибольшую зарядовую плотность среди щелочных металлов, что делает его электроны лучше привязанными к ядру. Фтор, в свою очередь, имеет больший заряд ядра и более высокую зарядовую плотность, что также обуславливает высокую энергию ионизации.
Калий (K), рубидий (Rb), цезий (Cs) и гафний (Fr) также имеют высокие значения энергии ионизации, которые увеличиваются по мере движения вниз по группе. У калия энергия ионизации составляет около 418 кДж/моль, у рубидия — 403 кДж/моль, у цезия — 376 кДж/моль и у гафния — 380 кДж/моль. Эти значения опять же объясняются увеличением зарядовой плотности и электростатической привлекательности между ядром и электронами с увеличением заряда и увеличением размера атома.
Следовательно, литий, фтор, калий, рубидий, цезий и гафний отличаются высокой энергией ионизации среди щелочных металлов, что делает их менее склонными к ионизации и более устойчивыми в химических реакциях. Эта особенность имеет важное значение при изучении и использовании щелочных металлов в различных областях науки и технологий.
Какие щелочные металлы имеют низкую энергию ионизации?
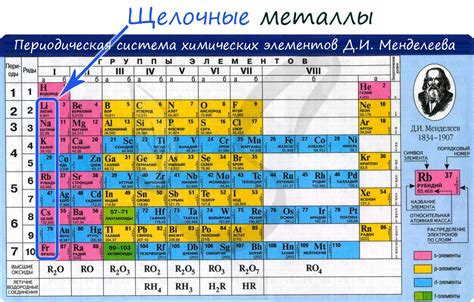
Щелочные металлы – это элементы периодической системы, которые входят в первую группу. Они включают такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти щелочные металлы имеют низкую энергию ионизации, что делает их отличными для использования в различных химических и физических процессах.
Конкретно, энергия ионизации – это энергия, которая необходима для удаления одного электрона из атома в единицу времени. Низкая энергия ионизации означает, что эти металлы легко теряют свои электроны и образуют положительные ионы.
Самый низкий уровень энергии ионизации имеет франций, который является самым редким и наименее стабильным из щелочных металлов. Затем идут цезий, рубидий, калий, натрий и литий, соответственно.
Энергия ионизации имеет важное практическое применение, например, в электрохимических средствах или солнечных батареях. Низкая энергия ионизации щелочных металлов обуславливает их активное взаимодействие с другими веществами, что делает их полезными в различных областях науки и технологий.
Влияние энергии ионизации на свойства щелочных металлов
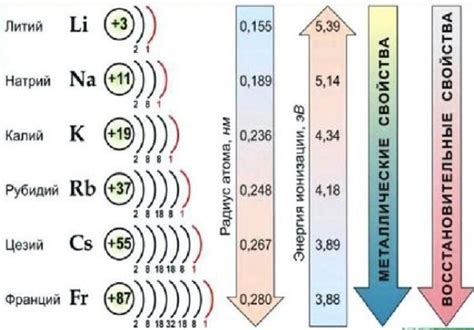
Энергия ионизации является одним из ключевых показателей, описывающих свойства щелочных металлов. Она определяет энергетическое уровень, необходимое для отрыва внешнего электрона от атома металла, образования иона положительного заряда.
Чем ниже энергия ионизации у щелочных металлов, тем легче происходит процесс ионизации и, следовательно, тем практически все свойства щелочных металлов зависят от этого показателя. Более низкая энергия ионизации означает, что атомы щелочных металлов имеют большую тенденцию образовывать ионы и более легко взаимодействуют с другими веществами.
Так, щелочные металлы с низкой энергией ионизации обладают высокой реакционной способностью. Они легко реагируют с водой, кислородом, сероводородом и другими веществами. Более того, они обладают высокой осадительной способностью, поэтому на практике используются для очистки воды или синтеза различных соединений.
Энергия ионизации также влияет на физические свойства щелочных металлов. Например, металлы с высокой энергией ионизации, такие как литий, обладают более высокой температурой плавления и кипения, а также более высокой плотностью. Это объясняется тем, что высокая энергия ионизации обусловливает теснее связь между атомами металла.
И энергия ионизации, и другие свойства щелочных металлов могут быть представлены в виде таблицы. Например, энергия ионизации возрастает вдоль периода в таблице Менделеева от лития до франция. А внутри одной группы щелочных металлов энергия ионизации увеличивается снизу вверх. Такая информация важна для понимания химических свойств и реактивности щелочных металлов.
Как кислотность или щелочность металла связана с его энергией ионизации?
Энергия ионизации щелочных металлов является важным параметром, который влияет на их кислотность или щелочность. Энергия ионизации определяет, насколько легко металл может отдать свой внешний электрон и превратиться в положительный ион. Чем ниже энергия ионизации, тем легче металл отдает свой электрон и тем более щелочным он является.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., имеют низкую энергию ионизации, что делает их очень хорошими донорами электронов. Это связано с их внутренней электронной конфигурацией, в которой внешний электрон находится на большом расстоянии от положительно заряженного ядра. Это приводит к слабому притяжению и к тому, что электрон легко отдается.
Когда щелочный металл отдает свой электрон, он образует положительный ион, который обладает щелочными свойствами. Чем меньше энергия ионизации, тем сильнее эти свойства проявляются, так как металл более легко отдает свой электрон. Это делает щелочные металлы сильными основаниями и хорошими реагентами в щелочных реакциях.
С другой стороны, металлы с высокой энергией ионизации, такие как алюминий (Al), железо (Fe), медь (Cu) и др., имеют большую тенденцию удерживать свои внешние электроны. Это связано с их большим зарядом ядра и более сильным притяжением к электронам. Поэтому эти металлы образуют катионы с высоким зарядом, и их растворы обладают кислотными свойствами.
Таким образом, энергия ионизации щелочных и кислотных металлов определяет их способность отдавать или принимать электроны, что в конечном итоге влияет на их кислотность или щелочность.
Значение энергии ионизации для технических и промышленных процессов

Энергия ионизации щелочных металлов является важным параметром, который оказывает влияние на различные технические и промышленные процессы. Энергия ионизации представляет собой энергию, необходимую для удаления одного электрона из атома вещества.
Щелочные металлы, такие как литий, натрий и калий, обладают низкой энергией ионизации. Это означает, что эти металлы легко отдают свои электроны и образуют положительные ионы. Благодаря этому свойству, щелочные металлы нашли широкое применение в различных технических и промышленных процессах.
Например, натрий и калий используются в процессе производства стекла. Из-за низкой энергии ионизации этих металлов, они могут быть легко ионизированы и внесены в стекломассу. Это позволяет значительно снизить температуру плавления стекла и улучшить его свойства.
Другим примером является использование щелочных металлов в батареях. Благодаря низкой энергии ионизации, литий широко применяется в литий-ионных аккумуляторах. Он обеспечивает высокую плотность энергии и длительное время работы. Кроме того, литий также является важным компонентом для производства высокоэнергетических взрывчатых веществ.
Таким образом, энергия ионизации щелочных металлов имеет огромное значение для различных технических и промышленных процессов. Она определяет их свойства и возможности применения в различных сферах. Понимание этого параметра позволяет разработать эффективные технологии и найти новые области применения щелочных металлов.
Вопрос-ответ

Какая связь есть между энергией ионизации щелочных металлов и их расположением в периодической таблице?
Энергия ионизации щелочных металлов увеличивается при движении от верхнего левого угла таблицы к нижнему правому. Это связано с уменьшением радиуса атомов и увеличением заряда ядра атома. Чем ближе электрон к ядру атома, тем сильнее будет притяжение и тем больше энергии понадобится для его отрыва.
Почему энергия ионизации щелочных металлов ниже, чем у других элементов периодической таблицы?
Энергия ионизации щелочных металлов ниже, потому что они имеют наибольший радиус атомов и наименьшую электроотрицательность из всех элементов периодической таблицы. У щелочных металлов также наличие одного электрона на внешней энергетической оболочке облегчает процесс ионизации. Это делает их наиболее реактивными металлами.
