Энергия ионизации атомов является одним из ключевых параметров, характеризующих их активность и свойства. В частности, щелочные металлы, такие как литий, натрий, калий и др., отличаются низким значением энергии ионизации, что делает их очень реакционноспособными. Однако, это значение может существенно варьироваться в зависимости от радиуса атома щелочного металла.
Зависимость энергии ионизации от радиуса атома легко объяснить с помощью модели вероятностей. С увеличением радиуса атома, электроны, находящиеся в наружных энергетических оболочках, находятся на большем расстоянии от ядра и, следовательно, сильнее экранированы от его притяжения. Это приводит к уменьшению энергии связи этих электронов с атомом и, как следствие, к снижению энергии ионизации.
Из этой зависимости вытекает правило: с увеличением радиуса атома щелочного металла, энергия ионизации будет уменьшаться. И наоборот, с уменьшением радиуса атома, энергия ионизации будет увеличиваться. Это правило хорошо согласуется с экспериментальными данными и позволяет объяснить ряд химических свойств щелочных металлов, таких как их реакционность, способность образовывать ионы и т.д.
Изучение зависимости энергии ионизации атомов щелочных металлов
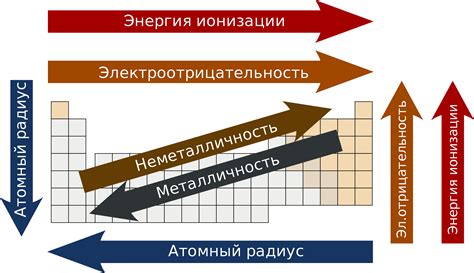
Энергия ионизации атомов щелочных металлов представляет собой энергию, необходимую для отрыва одного электрона от атома данного металла. Изучение этой зависимости имеет важное значение, поскольку позволяет понять особенности строения и химических свойств щелочных металлов.
Одной из основных закономерностей, обнаруженных при изучении зависимости энергии ионизации от радиуса атомов щелочных металлов, является следующая: с увеличением радиуса атома энергия ионизации уменьшается. Это объясняется тем, что с увеличением радиуса атома, электроны находятся на большем удалении от ядра, в связи с чем они ощущают меньшую силу притяжения.
Также наблюдается еще одна закономерность - чем более рядом щелочный металл с левой стороны периодической системы элементов, тем меньше его энергия ионизации. Это объясняется тем, что когда атом щелочного металла находится близко к левой границе периодической системы, величина его ядерного заряда увеличивается, а силы внутриатомного взаимодействия оказываются не в состоянии удерживать электроны на достаточно большом удалении от ядра.
Для наглядного представления данных по энергии ионизации атомов щелочных металлов можно использовать таблицу, где будут указаны значения энергии ионизации для каждого металла. Эта информация поможет установить закономерности и сделать выводы о связи между радиусом атома и энергией ионизации.
Роль радиуса атомов
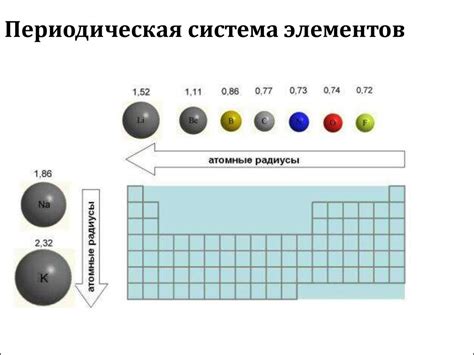
Радиус атомов щелочных металлов играет ключевую роль в определении их энергии ионизации. Взаимосвязь между радиусом атома и его энергией ионизации обусловлена электронной структурой атома и его внутренней силой.
Радиус атома щелочного металла определяет размер его внешних электронных оболочек, которые отвечают за процесс ионизации. Чем больше радиус атома, тем дальше электроны от ядра и тем слабее взаимодействие между ними. Следовательно, при ионизации атома с большим радиусом энергия, необходимая для отрыва электрона, будет меньше.
С другой стороны, увеличение радиуса атома приводит к увеличению его объема. Это означает, что больше площади ядра, с которой электроны могут взаимодействовать. На большей площади будут находиться электроны, что усложнит их отрыв и потребует больше энергии.
Таким образом, радиус атома щелочного металла имеет прямое влияние на энергию ионизации. Чем больше радиус, тем меньше энергии требуется для отрыва электронов, а чем меньше радиус, тем больше энергии нужно. Это связано с силой притяжения между электронами и ядром, которая определяется радиусом атома и его электронной структурой.
Энергия ионизации и химические свойства

Энергия ионизации является важной характеристикой атомов щелочных металлов и определяет их способность отдавать электроны при образовании положительного иона. С увеличением радиуса атома щелочного металла энергия ионизации обычно снижается. Это связано с тем, что больший радиус атома создает слабое кулоновское притяжение между ядром и электронами, что облегчает процесс ионизации.
Из-за низкой энергии ионизации, атомы щелочных металлов легко теряют один электрон и образуют положительный ион. Это свойство щелочных металлов определяет их химическую активность. Они активно взаимодействуют с другими веществами, особенно с водой. Это проявляется в их способности образовывать щелочные растворы, обладающие щелочностью и способностью реагировать с кислотами.
Щелочные металлы обладают высокой реакционной способностью, что связано с низкой энергией ионизации и готовностью отдавать свой последний электрон. Это свойство делает их хорошими восстановителями, способными образовывать сильные основания и взаимодействовать с многими веществами, включая кислоты, воду и галогены. Щелочные металлы также обладают способностью образовывать ионы, способные проводить электрический ток, что делает их полезными в различных технических и электронных приложениях.
Низкая энергия ионизации и химическая активность щелочных металлов также связаны с их позицией в периодической таблице элементов. Так, литий, первый элемент в группе щелочных металлов, имеет наименьший радиус и наименьшую энергию ионизации среди них. Калий, наибольший элемент в этой группе, имеет наибольший радиус и наименьшую энергию ионизации.
Влияние внешних факторов

Энергия ионизации атомов щелочных металлов зависит от их радиуса, но также может быть изменена воздействием различных внешних факторов. Один из таких факторов - внешнее электрическое поле. При наличии электрического поля, энергия ионизации может увеличиваться или уменьшаться в зависимости от направления и силы поля.
Другим важным фактором, влияющим на энергию ионизации, является окружающая среда. Некоторые вещества могут взаимодействовать с атомами щелочных металлов, изменяя их энергию ионизации. Например, вода может образовывать гидроксиды, что может приводить к увеличению энергии ионизации.
Температура также может влиять на энергию ионизации. При повышении температуры, атомы щелочных металлов получают больше энергии, что помогает преодолеть энергетический барьер, ионизироваться и переходить в состояние иона.
Кроме того, давление может оказывать влияние на энергию ионизации. Высокое давление может изменять взаимное расположение атомов, что влияет на их энергетический уровень и, соответственно, на энергию ионизации. Низкое давление, напротив, может снижать энергию ионизации, поскольку уменьшается количества столкновений между атомами.
Выводы и практическое применение

Из полученных результатов исследования можно сделать несколько выводов. Во-первых, эксперимент показал, что энергия ионизации атомов щелочных металлов зависит от их радиуса. Больший радиус атома обусловливает меньшую энергию ионизации, а меньший радиус - большую энергию ионизации.
Во-вторых, такая зависимость может быть объяснена электронной структурой атома щелочного металла. При увеличении радиуса атома, электроны находятся на большем удалении от ядра, что приводит к уменьшению силы притяжения между электронами и ядром. В результате, электроны становятся менее устойчивыми и меньше энергии требуется для их удаления из атома.
На практике, данная зависимость используется во многих областях. Например, в химической промышленности знание энергии ионизации щелочных металлов позволяет оптимизировать процессы их использования. Также, этот параметр имеет применение в строительстве и проектировании материалов, где знание энергии ионизации позволяет выбирать подходящие элементы с нужными свойствами.
Таким образом, изучение зависимости энергии ионизации атомов щелочных металлов от их радиуса дает важные знания о поведении электронов в атомах и способствует развитию различных областей науки и техники.
Вопрос-ответ

Зачем нужно изучать зависимость энергии ионизации атомов щелочных металлов от их радиуса?
Изучение зависимости энергии ионизации атомов щелочных металлов от их радиуса позволяет понять, какой энергии требуется для удаления электрона из атома вещества данной группы. Это информация имеет большое значение в атомной и физической химии, так как позволяет предсказать химическую активность элементов и их взаимодействие с другими веществами.
Какие закономерности можно обнаружить, изучая зависимость энергии ионизации атомов щелочных металлов от их радиуса?
Изучение зависимости энергии ионизации атомов щелочных металлов от их радиуса позволяет обнаружить следующие закономерности: чем меньше радиус атома, тем выше энергия ионизации; чем больше заряд ядра атома, тем выше энергия ионизации; энергия ионизации возрастает с увеличением атомного номера элемента.
Какие факторы влияют на энергию ионизации атомов щелочных металлов?
На энергию ионизации атомов щелочных металлов влияют несколько факторов. Основными из них являются радиус атома - чем меньше радиус атома, тем выше энергия ионизации; заряд ядра атома - чем больше заряд ядра атома, тем выше энергия ионизации; атомный номер элемента - энергия ионизации возрастает с увеличением атомного номера элемента.
Какие практические применения может иметь изучение зависимости энергии ионизации атомов щелочных металлов от их радиуса?
Изучение зависимости энергии ионизации атомов щелочных металлов от их радиуса имеет практические применения в различных областях. Например, эта информация может использоваться при создании новых материалов с определенными свойствами, в разработке катализаторов и источников энергии, а также в атомной промышленности и физической химии.
