Энергия ионизации атомов металлов играет важную роль в определении их реактивности. Ионизация атомов металлов происходит в процессе отщепления электрона от атома и образования положительно заряженного иона. Энергия, необходимая для этого процесса, называется энергией ионизации.
Высокая энергия ионизации указывает на то, что атом металла тесно удерживает свои электроны и имеет низкую склонность к образованию ионов. Следовательно, металл с высокой энергией ионизации будет реакционно инертным и малоактивным химическим элементом.
С другой стороны, металлы с низкой энергией ионизации легко отщепляют свои электроны и образуют положительные ионы. Эти атомы металлов имеют большую склонность к реакциям и активно участвуют в химических процессах. Такие металлы обладают высокой реактивностью и могут образовывать различные соединения с другими элементами.
Энергия ионизации атомов металлов может быть оказывает влияние на их физические и химические свойства. Кроме того, энергия ионизации является важным показателем степени стабильности и прочности связи атомов в металлической решетке. Знание энергии ионизации металлов позволяет предсказывать их поведение в различных реакциях и использовать их в различных промышленных процессах.
Металлы и их химическая реактивность

Металлы - это класс элементов, характеризующихся высокой электропроводностью и гибкостью, а также способностью образовывать положительные ионы, т.е. катионы. Их химическая реактивность определяется рядом факторов, таких как энергия ионизации, атомный радиус и степень окисления.
Энергия ионизации - это энергия, необходимая для удаления одного электрона из атома в состоянии основного энергетического уровня. Чем ниже энергия ионизации, тем меньше энергии требуется для удаления электрона и, следовательно, выше реактивность металла. Например, лютетий и натрий имеют низкую энергию ионизации и поэтому легко образуют катионы.
Атомный радиус также влияет на реактивность металлов. Чем больше атомный радиус, тем проще для металла лишиться электронов и, соответственно, выше его реактивность. Например, калий имеет больший атомный радиус, чем литий, и проявляет большую реактивность.
Степень окисления металла также влияет на его химическую реактивность. Металлы могут образовывать ионы различных степеней окисления, и в зависимости от степени окисления их реактивность может варьироваться. Например, железо может образовывать ионы с различными степенями окисления, что определяет его разнообразные свойства и реакционную способность.
В заключение, металлы и их химическая реактивность тесно связаны с такими факторами, как энергия ионизации, атомный радиус и степень окисления. Понимание этих факторов позволяет нам более глубоко изучать свойства металлов и предсказывать их реакционную способность в различных химических процессах.
Определение энергии ионизации

Энергия ионизации – это энергия, необходимая для удаления электрона из атома в его нейтральном состоянии. Она является мерой силы, с которой ядро притягивает электроны. Чем выше энергия ионизации, тем сильнее связан электрон с атомом и тем сложнее его удалить.
Энергия ионизации играет важную роль в определении реактивности металлов. Металлы с низкой энергией ионизации обладают большей склонностью отдавать электрон и образовывать положительные ионы, что делает их хорошими восстановителями в химических реакциях.
Существует два основных способа определения энергии ионизации: экспериментальный и теоретический. В экспериментальном методе используется специальное оборудование, позволяющее измерить энергию, необходимую для ионизации атома. Теоретический метод основан на расчете энергии ионизации с использованием квантово-механических моделей атома.
Энергия ионизации зависит от ряда факторов, включая заряд ядра, радиус атома, электронную конфигурацию и электронное состояние. Обычно энергия ионизации увеличивается с увеличением заряда ядра и уменьшением радиуса атома. Кроме того, она может меняться в пределах одного элемента в зависимости от электронной конфигурации и электронного состояния атома.
Энергия ионизации является важной характеристикой атомов металлов и играет решающую роль в их реактивности. Понимание и изучение этого параметра позволяет лучше понять химическое поведение металлов и использовать их в различных технологических процессах.
Что такое энергия ионизации
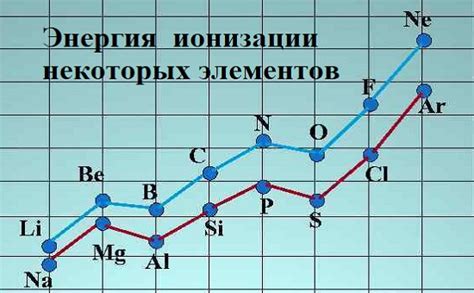
Энергия ионизации - это количество энергии, необходимое для удаления электрона с атома. Она является количественной мерой "прочности" связи между электроном и атомом и определяет реактивность металлов.
Высокая энергия ионизации означает, что электроны в атоме плотно удерживаются электростатическими силами, и для их отрыва должно быть затрачено большое количество энергии. Поэтому атомы металлов с высокой энергией ионизации не склонны терять электроны и имеют низкую реактивность.
Низкая энергия ионизации, напротив, означает, что связь между электроном и атомом слабая, и для освобождения электрона требуется меньше энергии. Атомы металлов с низкой энергией ионизации легко отдают электроны и проявляют высокую реактивность.
Энергия ионизации зависит от ряда факторов, включая заряд и размеры ядра атома, количество электронов и их распределение по орбиталям. На основе энергии ионизации можно составить ряд металлов по величине реактивности и использовать его для прогнозирования химических реакций и составления электрохимических рядов.
Влияние энергии ионизации на реактивность металлов
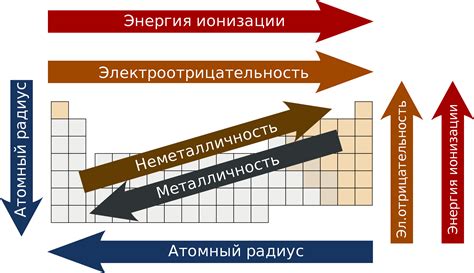
Энергия ионизации является важной характеристикой металлов, которая определяет их реактивность. Энергия ионизации – это энергия, необходимая для удаления электрона из валентной оболочки атома. Чем выше энергия ионизации, тем больше энергии требуется для отделения электрона, и тем менее реактивным является металл.
Высокая энергия ионизации у металлов говорит о том, что электроны в их валентной оболочке тесно связаны с ядром и не легко отдаются в химических реакциях. Это делает эти металлы менее активными при образовании соединений с другими элементами.
В то же время, металлы с низкой энергией ионизации обладают большей реактивностью, так как электроны в их валентной оболочке слабо связаны с ядром и легко участвуют в химических реакциях. Они образуют стабильные ионные соединения, давая электроны другим элементам с более высокой энергией ионизации.
Энергия ионизации также влияет на порядок реактивности металлов в ряду активности. Чем ниже энергия ионизации у металла, тем он более активен и занимает более высокое положение в ряду активности. Например, литий имеет низкую энергию ионизации и является самым активным металлом в группе щелочных металлов.
Таким образом, энергия ионизации играет важную роль в определении реактивности металлов. Высокая энергия ионизации делает металлы менее реактивными, в то время как низкая энергия ионизации делает металлы более активными и склонными к образованию соединений с другими элементами.
Факторы, определяющие энергию ионизации

1. Размер атома: Один из главных факторов, определяющих энергию ионизации, - это размер атома. Чем меньше размер атома, тем больше энергии требуется для удаления электрона из его валентной оболочки. Это связано с тем, что электроны находятся ближе к положительно заряженному ядру и ощущают большую электростатическую привлекательную силу.
2. Заряд ядра: Заряд ядра также влияет на энергию ионизации атомов металлов. Чем больше положительный заряд ядра, тем сильнее оно притягивает электроны валентной оболочки и тем больше энергии требуется для их удаления. Поэтому атомы металлов с большим зарядом ядра имеют более высокую энергию ионизации.
3. Силы отталкивания электронов: Силы отталкивания электронов, находящихся внутри атома, также играют роль в определении энергии ионизации. Как правило, электроны находятся на разных уровнях энергии, и чем ближе энергетические уровни к наружным оболочкам, тем сильнее проявляются силы отталкивания. Более сильные силы отталкивания требуют более высокой энергии для удаления электрона.
4. Конфигурация электронов: Конфигурация электронов в атоме также влияет на энергию ионизации. Например, атомы с полностью заполненными подуровнями или полуподуровнями обладают более высокой энергией ионизации, так как удаление электрона потребует нарушения стабильной конфигурации и энергетического барьера.
Итак, факторы, определяющие энергию ионизации атомов металлов, включают размер атома, заряд ядра, силы отталкивания электронов и конфигурацию электронов. Понимание этих факторов поможет нам лучше понять реактивность металлов и их способность отдавать электроны при взаимодействии с другими веществами.
Порядок в периодической таблице
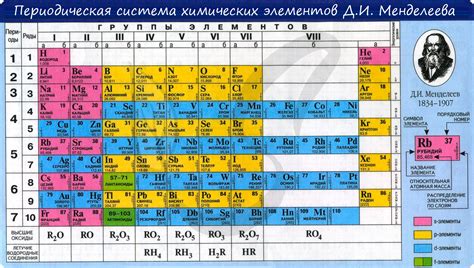
Периодическая таблица химических элементов представляет собой систематическое упорядочение всех известных нам химических элементов. Она состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами. Каждый элемент в таблице имеет свой уникальный атомный номер, который определяет его порядковое положение.
На основе периодической таблицы можно провести ряд закономерностей, которые помогают понять строение и свойства различных элементов. Например, элементы в одной и той же группе имеют схожие химические свойства и образуют одну и ту же оксидационную степень. Это связано с тем, что элементы в одной группе имеют одно и то же количество валентных электронов.
Также в периодической таблице можно заметить закономерность изменения энергии ионизации элементов по горизонтали и по вертикали. Ионизационная энергия - это энергия, необходимая для удаления одного электрона из атома. Общая тенденция заключается в увеличении энергии ионизации от левого верхнего угла таблицы к правому нижнему углу. Это объясняется увеличением заряда ядра и понижением размера атома, что делает удаление электрона более сложным.
Порядок в периодической таблице имеет огромное значение для понимания структуры и свойств химических элементов. Он позволяет установить связи между различными элементами, предсказать их реактивность и свойства, а также помогает ориентироваться в многообразии химических соединений и веществ.
Вопрос-ответ

Что такое энергия ионизации атомов металлов?
Энергия ионизации атомов металлов - это энергия, необходимая для удаления одного электрона из атома металла в единицу времени. Все металлы имеют различную энергию ионизации, которая зависит от их электронной структуры и положения в периодической таблице.
Какие факторы определяют энергию ионизации атомов металлов?
Энергия ионизации атомов металлов зависит от таких факторов, как радиус атома, заряд ядра, количество и распределение электронов в оболочках атома и присутствие других атомов или ионов поблизости. Чем больше радиус атома и чем слабее притяжение между электронами и ядром, тем меньше энергия ионизации.
Как энергия ионизации атомов металлов связана с их реактивностью?
Энергия ионизации атомов металлов является одним из факторов, определяющих их реактивность. Чем ниже энергия ионизации, тем легче атому отдать электрон и образовать положительный ион. Это делает металлы более реактивными, так как они готовы образовывать соединения с другими веществами.
Какие металлы имеют самую низкую энергию ионизации?
Металлы с самой низкой энергией ионизации находятся в левом нижнем углу периодической таблицы элементов. К таким металлам относятся литий, натрий, калий, рубидий и цезий. У этих металлов наружный электрон находится на большом расстоянии от ядра и слабо притягивается к нему, что делает их очень реактивными.
Можете ли вы привести пример металла с высокой энергией ионизации?
Один из примеров металла с высокой энергией ионизации - это хром. У него высокая энергия ионизации из-за сильного притяжения между электронами и ядром. Хром является не столь реактивным металлом, что делает его полезным для различных применений, таких как красители, покрытия и сплавы.
