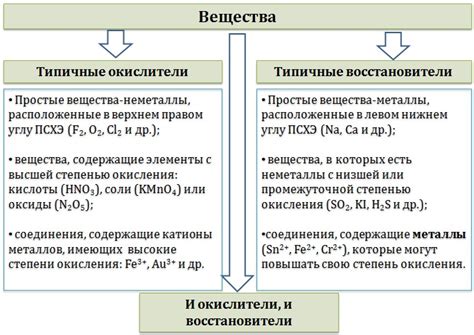
Металлы активные к энергичным окислителям представляют собой элементы, которые имеют высокую активность в реакциях с окислителями. Они способны образовывать стравливающие соединения с различными продуктами окисления, что делает их важными ингредиентами в различных областях науки и промышленности.
Одним из основных представителей металлов активных к энергичным окислителям является калий. Он обладает высокой реакционной способностью и может вступать во взаимодействие с различными окислителями, такими как хлор и сульфат. Также калий является необходимым элементом для многих жизненно важных процессов, таких как работа мышц и нервной системы.
Еще одним примером металла, активного к энергичным окислителям, является алюминий. Он широко используется в промышленности благодаря своей способности быстро вступать в реакцию с окислителями. Алюминий используется для производства различных металлических сплавов и материалов, а также в процессе электролиза и производства огнеупорных материалов.
В заключение, металлы активные к энергичным окислителям играют важную роль в различных областях науки и промышленности. Их способность реагировать с окислителями позволяет использовать их в процессах производства и реализации различных химических реакций. Эти металлы также являются неотъемлемыми компонентами жизненно важных процессов организмов и промышленных технологий.
Определение активных металлов

Активными металлами называются элементы, которые обладают высокой реакционной способностью и способны вступать в химические реакции с энергичными окислителями. Эти металлы обладают низкой электроотрицательностью и, как правило, имеют более низкую энергию ионизации.
Одним из наиболее известных активных металлов является литий (Li). Он обладает высокой активностью и реагирует с водой, выделяясь горючим газом. Также активными металлами являются натрий (Na), калий (K) и кальций (Ca).
Определение активных металлов может проводиться по нескольким признакам. Во-первых, активные металлы имеют способность активно окисляться в химических реакциях. Во-вторых, они проявляют реакционную способность при взаимодействии с кислородом, водой и другими окислителями. В-третьих, активные металлы относительно легко образуют положительные ионы и часто используются в различных химических процессах.
Активные металлы часто используются в промышленности и научных исследованиях благодаря своим уникальным свойствам. Их реактивность и способность вступать в реакции с окислителями позволяют использовать их в различных химических процессах, включая производство металлов и сплавов, производство электродов и аккумуляторов, а также в других областях промышленности.
Свойства активных металлов

Активные металлы - это элементы, которые обладают выраженной склонностью к реакциям с окислителями. Они легко отдают электроны и вступают в химические реакции, в результате чего образуют положительно заряженные ионы.
Одним из наиболее распространенных свойств активных металлов является способность реагировать с водой. При контакте активных металлов, таких как натрий, калий или литий, с водой происходит сильное образование водорода и образуется основание. Эта реакция происходит очень быстро и с высвобождением большого количества тепла.
Еще одним из характерных свойств активных металлов является способность к окислению. Активные металлы легко окисляются воздухом, при этом на их поверхности образуется оксидный слой, который защищает металл от дальнейшего окисления. Некоторые активные металлы, такие как калий или цезий, могут окисляться и гореть на воздухе даже без внешнего источника огня.
Также активные металлы проявляют свою активность при взаимодействии с кислотами. Они способны отдавать электроны кислоте, образуя соли и выделяя водород. Эта реакция протекает очень быстро и сопровождается выделением тепла.
Примеры активных металлов

Литий – один из самых активных и легких металлов, хранящийся под покровом сильного азота. Вещество, с реакцией окисления воздухом, образует оксид и пероксид лития, из-за чего взрывается. В некоторых случаях литий может прореагировать с водой, возникает немедленное воспламенение горения.
Натрий – еще один активный металл, который в начале реакции имеет сильное белое пламя. Это результат взаимодействия натрия с кислородом. Реагирует с водой, заливаются веществом, вызывающим яркое горение.
Калий – активный элемент, который также реагирует с водой с выделением большого количества горючих газов. Этот эффект обусловлен генерацией разрядов в случае их соприкосновения.
Цезий – еще один из активных металлов, относящихся к группе мощных окислителей. Реагирует с водой до того, как образуется больше шести газов.
Фермий – активный элемент, относящийся к активным металлам. Взаимодействует с некоторыми веществами, что может вызывать воспламенение.
Энергичные окислители и их роль
Энергичные окислители - это вещества, которые обладают высокой активностью в окислительно-восстановительных реакциях и способны эффективно окислять другие вещества. Они играют важную роль в различных процессах, как в природе, так и в промышленности.
Роль энергичных окислителей очень разнообразна. Они используются в производстве химических реакций, в технологичных процессах и в производстве различных веществ. Например, они могут быть применены в процессах хлорации, беления, оксидации и детоксикации. Они также широко используются в процессах очистки воздуха, воды и почвы.
Энергичные окислители способны вызывать окисление органических и неорганических веществ, что может привести к различным эффектам. Например, окисление органических веществ может приводить к разрушению молекул, устранению вредных органических веществ и улучшению качества воды или воздуха. В то же время, окисление неорганических веществ может приводить к образованию новых соединений и изменению их свойств.
Использование энергичных окислителей требует аккуратного обращения, так как они могут быть опасными и вызывать взрывоопасные реакции. Поэтому важно соблюдать все меры безопасности при работе с ними и правильно хранить эти вещества.
Свойства энергичных окислителей
Энергичные окислители - это вещества, которые способны активно вступать в реакцию с другими веществами, передавая им кислород или получая электроны. Они обладают определенными свойствами, которые делают их эффективными в качестве окислителей.
Высокая окислительная активность: Одним из главных свойств энергичных окислителей является их способность активно окислять другие вещества. Они обладают высокими энергетическими характеристиками, которые позволяют им эффективно переносить электроны или кислород.
Реакционная способность: Энергичные окислители обладают высокой реакционной способностью, то есть они быстро и эффективно вступают в реакцию с другими веществами. Это позволяет им осуществлять окисление и получать нужные продукты реакции.
Наличие высокого окислительного потенциала: Окислительный потенциал определяет способность вещества принимать или отдавать электроны. Энергичные окислители обладают высоким окислительным потенциалом, что делает их эффективными в процессе окисления других веществ.
Химическая устойчивость: Некоторые энергичные окислители обладают химической устойчивостью, что означает их способность оставаться стабильными при хранении и обработке. Это особенно важно, так как они могут быть опасными и требуют особого обращения.
Широкий спектр применения: Благодаря своим свойствам, энергичные окислители находят широкое применение в различных областях. Они используются в производстве взрывчатых веществ, окислителях для ракетного топлива, а также в химической промышленности и медицине.
Примеры энергичных окислителей
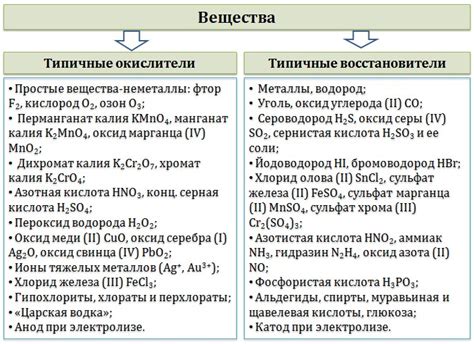
Энергичные окислители - это вещества, способные быстро и эффективно окислять другие вещества, отдавая электроны и вступая в реакцию. В результате такой окислительной реакции происходит выделение энергии, которая может использоваться в различных процессах.
Одним из примеров энергичных окислителей является сильная окислительная кислота - перхлоровая кислота (HClO4). Она обладает высокой степенью окисления и активно взаимодействует с органическими и неорганическими веществами, вызывая их окисление. Применяется перхлоровая кислота, например, в химическом синтезе, при анализе и в других процессах, где требуется сильное окисление.
Другим примером энергичного окислителя является кислород (O2). Он является сильным электрофильным окислителем и обладает высокой энергией окисления. Взаимодействуя с другими веществами, кислород способен вызывать их окисление, сжигание и выделение энергии в виде света и тепла. Кислород широко используется в процессах сгорания и окисления в различных отраслях промышленности, а также в дыхании организмов.
Еще одним примером энергичного окислителя является хлор (Cl2). Он обладает высокой окислительной способностью и активно взаимодействует с другими веществами, особенно с органическими соединениями. Хлор используется в процессе обеззараживания воды, в производстве различных химических соединений и других отраслях промышленности.
Взаимодействие активных металлов с энергичными окислителями

Активные металлы проявляют повышенную химическую активность при взаимодействии с энергичными окислителями. Это связано с их высокой электроотрицательностью и способностью легко отдавать электроны в реакционных средах. Такие металлы, как натрий, калий, магний и алюминий, активно реагируют с окислителями, такими как хлор, бром, йод и кислород.
Когда активные металлы вступают во взаимодействие с энергичными окислителями, происходят реакции окисления, в результате которых металлы теряют свои электроны и образуют соединения с положительными зарядами. При этом окислители получают электроны от металлов и превращаются в соответствующие анионы, обладающие отрицательным зарядом.
Взаимодействие активных металлов с энергичными окислителями может сопровождаться резким выделением тепла и отдельной разстворяемостью металла. Например, реакция натрия с кислородом сопровождается ярким пламенем и образованием оксида натрия. При реакции калия с хлором происходит вспышка и образование хлорида калия.
Важно отметить, что взаимодействие активных металлов с энергичными окислителями может быть опасным и должно проводиться с особым вниманием и мерами безопасности. Для предотвращения аварий, связанных с возможным воспламенением или взрывом, необходимо соблюдать правила хранения и использования активных металлов и энергичных окислителей.
Вопрос-ответ

Какие металлы являются активными к энергичным окислителям?
Металлы, являющиеся активными к энергичным окислителям, включают в себя литий, калий, натрий, барий, стронций и ряд других элементов.
Почему металлы активны к энергичным окислителям?
Металлы активны к энергичным окислителям из-за своей высокой реакционной способности. Они обладают низкими энергиями ионизации и сильной тенденцией к отдаче электронов другим элементам, таким образом, они быстро реагируют с энергичными окислителями, предоставляя им электроны и образуя ионы металла.
С какими энергичными окислителями металлы могут реагировать?
Металлы могут реагировать с различными энергичными окислителями, такими как кислород, хлор, фтор, серный третутиф, бром, иод и другие. Эти окислители способны энергично отнимать электроны от металлов, вызывая окислительно-восстановительные реакции.
В чем заключаются практические применения металлов активных к энергичным окислителям?
Металлы активные к энергичным окислителям широко используются в различных сферах, включая металлургию, химическую промышленность, электронику и производство батарей. Они служат важным компонентом реактивов и катализаторов, а также находят применение в создании легких, прочных и долговечных материалов.
