Щелочные металлы и щелочноземельные металлы - это элементы, которые находятся в первой группе периодической таблицы химических элементов. Оба типа металлов имеют низкую плотность и хорошую проводимость тепла и электричества.
Щелочные металлы, такие как литий, натрий и калий, расположены в верхней части первой группы. Они хорошо растворимы в воде и реагируют с ней с выделением водорода. Эти металлы обладают низкой плотностью и мягкостью и имеют низкую температуру плавления и кипения.
Щелочноземельные металлы, такие как бериллий, магний и кальций, находятся ниже щелочных металлов в первой группе. Они являются более плотными и имеют более высокие температуры плавления и кипения. Эти металлы также реагируют со водой, хотя не так активно, как щелочные металлы.
Оба типа металлов имеют широкое применение в различных отраслях промышленности и технологии. Щелочные металлы используются в производстве аккумуляторных батарей, а щелочноземельные металлы применяются в легкой промышленности, строительстве и электронике.
Свойства и химический состав щелочных металлов
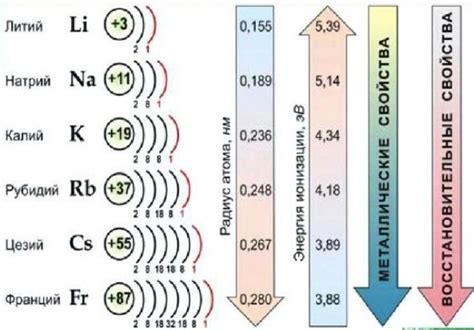
Щелочные металлы - это элементы, входящие в первую группу периодической системы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они являются самыми реактивными металлами в периодической системе.
Одним из характерных свойств щелочных металлов является их мягкость и низкая плотность. Например, литий - самый легкий металл, обладающий плотностью всего 0,53 г/см³. Они также хорошо проводят тепло и электричество.
Щелочные металлы обладают способностью быстро реагировать с кислородом воздуха, поэтому они хранятся под слоем безводной среды или в нефтяных жидкостях. Они также очень реактивны с водой, образуя щелочные растворы, при этом выделяется водород.
Что касается химического состава щелочных металлов, то они отличаются наличием одной валентной электронной оболочки. Это делает их очень хорошими элементами для создания ионов, которые обладают положительным зарядом. В качестве примера можно привести натрий, чей ион имеет заряд +1 и обозначается как Na+.
Описание группы 1 периодической таблицы и составляющих ее элементов
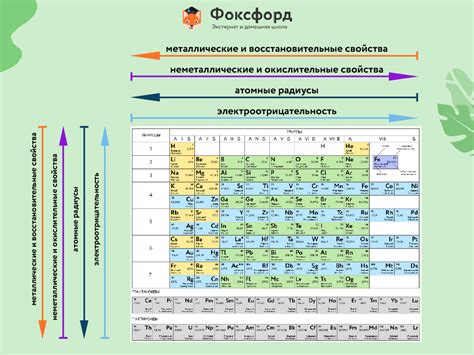
Группа 1 периодической таблицы элементов включает в себя щелочные металлы – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), а также щелочноземельные металлы – бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы характеризуются сходными свойствами и относятся к сильно-основным металлам.
Щелочные металлы обладают высокой реактивностью, быстро окисляются на воздухе и реагируют с водой, выделяя водород и образуя гидроксиды. Они имеют низкую плотность, низкую температуру плавления и кипения, а также низкую твердость. Щелочные металлы являются отличными проводниками тепла и электричества.
Щелочноземельные металлы, в свою очередь, менее реактивны, но все равно более активны, чем большинство других металлов. Они образуют белоснежные оксиды, гидрооксиды и гидроксоксиды. Щелочноземельные металлы обладают более высокой плотностью, температурой плавления и кипения, а также твердостью по сравнению со щелочными металлами.
Оба класса элементов группы 1 периодической таблицы характеризуются низким энергией ионизации, что делает их хорошими веществами для создания силециевых полупроводников. Они также широко применяются в производстве пиротехнических смесей, батарей, сплавов и легированных сталей.
Вопрос-ответ

Какие элементы входят в подгруппу 1 группы?
В подгруппу 1 группы входят щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), а также щелочноземельные металлы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают следующими характерными свойствами: мягкость и низкую температуру плавления, они хорошо растворимы в воде, образуя щелочные растворы, высокую активность и реактивность, способность к образованию ионов положительного заряда (катионов), яркую окраску в пламени при горении.
