Галогены и щелочные металлы представляют собой основные элементы первой группы периодической системы химических элементов. Они имеют сходную химическую природу и обладают рядом общих свойств и характеристик.
К галогенам относятся элементы фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они являются самыми активными неметаллами и имеют высокую электроотрицательность. Галогены легко вступают в химические реакции, особенно с щелочными металлами из первой группы.
Щелочные металлы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), являются самыми активными металлами в периодической системе. Они обладают низкой электроотрицательностью и легко отдают свои внешние электроны, образуя положительные ионы.
Галогены и щелочные металлы часто совместно применяются в различных химических реакциях и процессах, таких как образование солей и выделение галогенов.
Использование галогенов и щелочных металлов имеет широкие практические применения, от производства солей и лекарств до использования в электрохимических процессах и светотехнике.
Галогены и щелочные металлы:
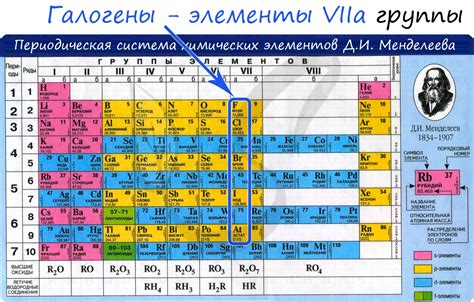
Галогены и щелочные металлы - это две основные группы элементов в периодической системе. Галогены находятся в 17-й группе, а щелочные металлы - в 1-й. Они обладают различными свойствами и играют важную роль в химии и технологии.
Галогены, включающие фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At), характеризуются высокой реактивностью и способностью образовывать хлориды, бромиды, йодиды и т.д. Они имеют ярко выраженный цвет и запах. Галогены используются в различных областях, включая производство пластмасс, удобрений, лекарств и очистку воды.
Щелочные металлы - литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr) - являются мягкими металлами со слабой электроотрицательностью. Они хорошо растворяются в воде и образуют гидроксиды, известные как щелочи. Щелочные металлы используются как источники энергии в батареях, для производства лекарств, стекла и других материалов.
Сочетание галогенов и щелочных металлов может приводить к реакциям, образующим соляные соединения. Например, хлорид натрия (NaCl) и бромид калия (KBr) - это примеры таких соединений. Галогены и щелочные металлы играют важную роль в биохимии, катализе и других химических процессах.
В целом, галогены и щелочные металлы имеют важное значение в различных областях науки и промышленности. Их химические свойства и реактивность позволяют использовать их в различных процессах и технологиях, способствуя развитию и улучшению нашей жизни.
Основные элементы
Основными элементами 1 группы периодической системы являются щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к металлам, имеют низкую плотность и низкую температуру плавления. Все они обладают ярко выраженным металлическим блеском и хорошей электропроводностью.
Щелочные металлы имеют химически активные свойства и легко образуют ионы положительного заряда (катионы). Они реагируют с водой, образуя щелочь и выделяя водород. Также они реагируют с кислородом и хлором, образуя оксиды и хлориды соответственно.
Элементы 1 группы обладают высокой реакционной способностью и являются сильными редукторами. Их соединения широко используются в промышленности и в жизни. Например, калий и натрий используются в пищевой промышленности для консервирования и приготовления пищи. Литий применяется в производстве аккумуляторов, а рубидий и цезий используются в научных исследованиях и в электронике.
Группы

В периодической системе элементов все химические элементы разделены на группы в соответствии с их свойствами. Каждая группа имеет свое название, номер и символ. Одна из важнейших групп – это первая группа, которая включает галогены и щелочные металлы.
Первая группа состоит из щелочных металлов – лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Щелочные металлы характеризуются высокой реактивностью, низкой плотностью и низкой температурой плавления. Они являются отличными проводниками электричества и обладают свойством быть мягкими и легкими металлами.
Галогены – это элементы, которые находятся в седьмой группе периодической системы. К ним относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Галогены являются неметаллами и имеют высокую электроотрицательность. Они обладают ярко выраженными химическими свойствами и могут образовывать соли с щелочными металлами.
Группы элементов в периодической системе помогают организовать и классифицировать различные элементы в соответствии с их общими свойствами. Они также помогают ученым изучать интеракции и реакции между элементами и предсказывать их химическое поведение на основе их групповой принадлежности.
Галогены - элементы 1 группы
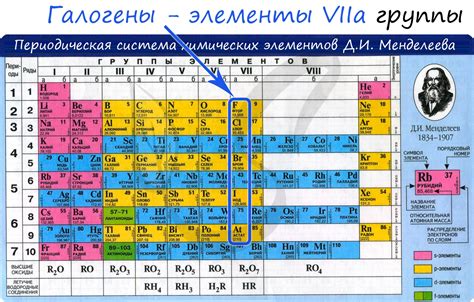
Галогены - это элементы 1 группы периодической системы, включающей флуор, хлор, бром, йод и астат.
Они отличаются высокой реактивностью и образованием легко растворимых солей. Имеют характерные свойства: яркий цвет, высокую электроотрицательность, низкую температуру плавления и кипения.
Галогены образуют сильные окислители и хорошо вступают в реакции с металлами. Взаимодействуя с металлами, они образуют соли. Например, реакция натрия с хлором приводит к образованию хлорида натрия, NaCl.
Галогены также обладают свойством образовывать водородные соединения с щелочными металлами, такими как литий, натрий, калий. Эти соединения обладают химической активностью, что делает их полезными в промышленности.
Интересно отметить, что галогены имеют важное значение в биологических системах. Например, йод играет важную роль в работе щитовидной железы, фтор используется в зубной пасте для предотвращения кaries.
Особенности галогенов

1. Электроотрицательность – галогены являются самыми электроотрицательными элементами среди всех химических элементов. Они имеют очень высокую способность притягивать электроны к своей оболочке, что делает их хорошими оксидантами в химических реакциях.
2. Наличие 7 электронов во внешней оболочке – у галогенов на последнем энергетическом уровне находится 7 электронов. Из-за этого они имеют большую склонность к образованию ионов с отрицательным зарядом, что делает их сильными агентами окисления.
3. Состояния окисления -1 – галогены имеют готовность к получению одного электрона, что приводит к образованию ионов с зарядом -1. Такие ионы называются галогенид-ионами и образуют соли с щелочными металлами и некоторыми другими металлами.
4. Высокая реактивность – из-за высокой электроотрицательности и наличия 7 электронов во внешней оболочке, галогены проявляют высокую реактивность и легко вступают в химические реакции с другими веществами. Они способны образовывать соединения с многими элементами и могут вытеснять менее электроотрицательные элементы из их соединений.
5. Химическая активность – галогены легко соединяются с многими элементами и образуют с ними разнообразные химические соединения. Они могут образовывать галогениды, галогениды водорода, кислотные и анионные галогеноводородные соединения, оксиды и другие соединения.
Галогены в природе

Галогены - это химические элементы, включающие фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). В природе они встречаются в различных формах и соединениях.
Фтор является самым химически активным галогеном и в природе встречается в виде минерала флюорита (CaF2), а также в соединениях с другими элементами, такими как фториды.
Хлор также широко распространен в природе и часто встречается в виде минерала галита (NaCl), который является основным источником получения крупных объемов хлора.
Бром обычно присутствует в виде минералов, таких как бримиды или галогениты, и в морской воде. Также бром содержится в ряде органических соединений.
Иод присутствует в океанской воде, в морских водорослях и рыбе. Главным источником получения иода являются его соли, такие как йодид калия (KI).
Астат, самый редкий галоген, встречается в природе в очень малых количествах и является продуктом распада урана и тория.
Основные резервы галогенов находятся в морской воде, почвах и некоторых рудах. Галогены имеют важное значение как химические элементы и используются в различных сферах, включая производство химических соединений, лекарств и дезинфицирующих средств.
Вопрос-ответ

Что такое галогены?
Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они находятся в 17-й группе периодической системы элементов и отличаются высокой реактивностью и химической активностью.
Какие свойства характерны для галогенов?
Галогены обладают следующими свойствами: высокая электроотрицательность, низкая температура кипения и плавления, высокая растворимость в воде, сильное окрашивание растворов и многоярусный электронный конфигурация.
Какие основные элементы входят в 1 группу периодической системы?
Основные элементы 1 группы периодической системы включают следующие щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают низкой плотностью, низкой температурой плавления и реактивностью.
Какие общие свойства имеют галогены и щелочные металлы?
Галогены и щелочные металлы имеют следующие общие свойства: высокая химическая активность, низкая температура плавления и кипения, хорошая растворимость в воде, образование ионов с отрицательным зарядом и способность образовывать стабильные соединения с другими элементами.
