Щелочные металлы - это группа элементов периодической системы, которые являются самыми активными металлами. В эту группу входят литий, натрий, калий, рубидий, цезий и франций. Они получили свое название "щелочные" из-за своей способности образовывать щелочные (шкалине) растворы при реакции с водой.
Основные физические свойства щелочных металлов связаны с их металлической природой. Они обладают серебристым цветом, низкой плотностью и мягкостью. Эти металлы легко режутся ножом и на них оставляются следы при трении о другие поверхности. Их электронная структура позволяет им образовывать ионы +1 заряда, что делает их очень реактивными.
Одной из особенностей щелочных металлов является их реакция с водой. При контакте с водой они реагируют с выделением водорода и образованием щелочных растворов. Реакция калия с водой, например, происходит с большим выделением тепла и ярким пламенем, что делает ее очень опасной и взрывоопасной. Эти металлы также реагируют со многими неметаллами и образуют соединения с различными элементами.
Определение щелочных металлов

Щелочные металлы – это группа химических элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они относятся к первой группе периодической системы химических элементов и обладают рядом схожих физических и химических свойств.
Основными характеристиками щелочных металлов являются их низкая плотность, мягкость, низкая температура плавления и высокая реактивность. Они обладают высокой электроотрицательностью и легко образуют ионы, ионизируя свои атомы и теряя одну внешнюю электронную оболочку. Это делает их крайне реактивными в химических реакциях и способными гореть при контакте с кислородом.
Еще одна характеристика щелочных металлов – их способность образовывать гидроксиды, такие как лист водорода (LiOH), гидроксид натрия (NaOH), гидроксид калия (KOH) и другие. Гидроксиды щелочных металлов сильно щелочные соединения и обладают свойством растворяться в воде, что делает эти элементы незаменимыми в жизни организмов.
Общая информация о составе и свойствах щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они расположены в первой группе таблицы периодических элементов. Эти металлы имеют сходные свойства и играют важную роль в различных процессах в природе и промышленности.
Щелочные металлы обладают высокой активностью химической реактивности из-за низкой энергии ионизации своего внешнего электрона. Это делает их устойчивыми в самом низком окислительном состоянии, и они легко образуют однозарядные катионы. Щелочные металлы очень реактивны с кислородом, водой и другими элементами, в результате чего образуются растворимые гидроксиды и другие соединения.
Основные физические свойства щелочных металлов - низкая плотность, низкая температура плавления и кипения, а также мягкость. Например, литий является самым легким металлом, а цезий имеет самую низкую температуру плавления. Щелочные металлы также отличаются высокой электропроводностью и теплопроводностью.
Элементы этой группы широко используются в различных областях. Например, натрий находит применение в пищевой промышленности и производстве стекла, калий играет важную роль в живых организмах как макроэлемент, а литий используется в производстве аккумуляторов и лекарственной промышленности. Щелочные металлы также используются в ядерной энергетике и в других технических процессах благодаря их химическим свойствам и уникальным свойствам.
Химический состав щелочных металлов
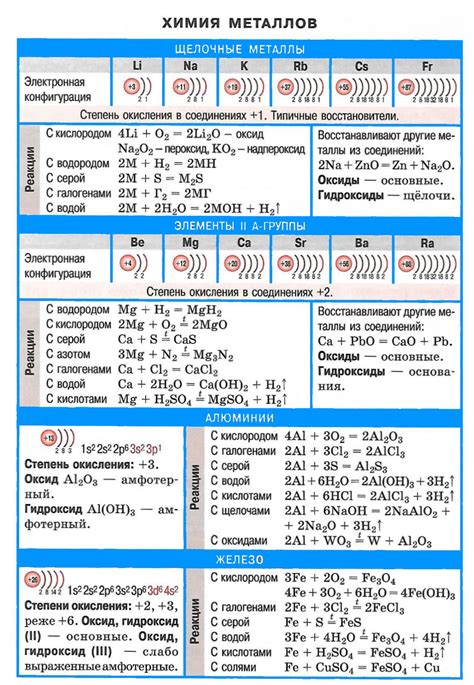
Щелочные металлы – это группа элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Все щелочные металлы имеют лишь один электрон во внешней электронной оболочке, что делает их очень реактивными.
Литий – самый легкий из щелочных металлов. Он обладает наименьшей массой и плотностью среди них. Литий имеет атомный номер 3 и обычно находится в виде соединений, таких как литий-ионные аккумуляторы. Его химический символ Li происходит от греческого слова "λίθος" (lithos), что означает "камень".
Натрий – второй щелочный металл. Он является очень активным химическим элементом и легко реагирует с водой и кислородом воздуха. Натрий находится во многих соединениях, таких как соль, поваренная сода и стекло. Его химический символ Na происходит от латинского слова "natrium".
Калий – третий щелочный металл. Он является одним из самых распространенных элементов в земной коре и встречается во множестве минералов и растений. Калий используется в сельском хозяйстве как удобрение и в производстве стекла. Его химический символ K происходит от немецкого слова "kalium".
Рубидий – четвертый щелочный металл. Он похож на калий по своим химическим свойствам и широко используется в научных исследованиях и электронике. Рубидий имеет много изотопов, но два из них, рубидий-85 и рубидий-87, наиболее распространены. Его химический символ Rb происходит от латинского слова "rubidus", что означает "темно-красный".
Цезий – пятый щелочный металл. Он является самым реактивным из всех щелочных металлов и может взорваться при контакте с водой. Цезий используется в научных исследованиях, электронике и в некоторых медицинских процедурах. Его химический символ Cs происходит от латинского слова "caesius", что означает "голубой".
Франций – последний и наиболее редкий из щелочных металлов. Он является самым тяжелым щелочным металлом и обладает наименьшей стабильностью. Франций очень реактивен и быстро окисляется на воздухе. Его химический символ Fr происходит от страны Франция, где он был открыт в 1939 году.
Физические свойства щелочных металлов

Щелочные металлы представляют собой ряд элементов, расположенных в первой группе периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы имеют ряд характерных физических свойств, которые делают их отличительными от других элементов.
Одной из основных характеристик щелочных металлов является их низкая плотность. Литий и калий – самые легкие металлы, их плотность составляет около 0,5 г/см³. Натрий и рубидий имеют плотность около 0,9 г/см³, а цезий – около 1,9 г/см³. Такая низкая плотность связана с малым атомным радиусом и большим межатомным расстоянием у этих элементов.
Вторым важным физическим свойством щелочных металлов является их низкая температура плавления и кипения. Литий плавится при температуре около 180°C, натрий – при 98°C, калий – при 64°C, рубидий – при 39°C, цезий – при 28°C. Такое низкое значение связано с низкой величиной межатомных сил притяжения, вызванных большими атомными радиусами и отсутствием сильных сил сцепления.
Третье характерное свойство щелочных металлов – их мягкость и пластичность. Вследствие слабой силы взаимодействия атомов эти металлы могут быть легко деформированы под действием небольшого давления или удара. Например, кусок калия с легкостью может быть раздавлен пальцами.
Еще одним важным свойством щелочных металлов является их хорошая проводимость тепла и электрического тока. Это связано с тем, что у атомов щелочных металлов низкая энергия ионизации, что способствует образованию положительной ионы в их соединениях и образованию свободных электронов.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов, которые находятся в первой группе периодической таблицы. Их химические свойства обусловлены большой активностью этих элементов.
Щелочные металлы имеют высокую реакционную способность и легко вступают в химические реакции с другими веществами. Одной из характерных особенностей щелочных металлов является их способность реагировать с водой. При взаимодействии с водой щелочные металлы выделяются водородом и образуют гидроксиды.
Щелочные металлы также проявляют активность при взаимодействии с кислородом. Они горят на воздухе, образуя оксиды, которые могут быть растворимыми в воде. Реакция щелочных металлов с кислородом сопровождается выделением большого количества тепла.
Другими важными химическими свойствами щелочных металлов являются их реакции с кислотами и солями. Щелочные металлы способны реагировать с кислотами, образуя соль и выделяя водород. Также их реакции с солями приводят к образованию новых солей.
Щелочные металлы встречаются в природе в виде соединений, таких как соли и минералы. Эти элементы широко используются в различных отраслях промышленности, в том числе в производстве стекла, мыла, щелочей и других химических веществ.
Вопрос-ответ

Какие элементы относятся к группе щелочных металлов?
К группе щелочных металлов относятся элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы свойства щелочных металлов?
Щелочные металлы обладают следующими свойствами: они очень реактивны и легко вступают в химические реакции; они имеют низкую плотность и низкую температуру плавления; они образуют ионы с положительным зарядом и обладают металлическим блеском.
Каковы основные применения щелочных металлов?
Щелочные металлы имеют множество применений. Например, литий используется в производстве аккумуляторов и лекарств; натрий используется в пищевой промышленности и производстве стекла; калий применяется в сельском хозяйстве и производстве удобрений; рубидий и цезий используются в научных исследованиях и в производстве электроники.
