Валентность элементов является одним из основных характеристик химических элементов, определяющих их способность образовывать соединения с другими элементами. Интересно, что большинство элементов металлов обладают валентностью, равной двум. Что обуславливает эту особенность?
Валентность элемента в химическом соединении определяет количество валентных электронов, то есть электронов, участвующих в химических связях. Общая формула для определения валентности металлов - это их группа в таблице Менделеева. Например, металлы из группы 1 имеют валентность 1, металлы из группы 2 - валентность 2, и так далее. Однако, существует множество исключений из этого правила, и металлы с разными группами могут иметь одну и ту же валентность. Но почему большинство металлов имеют валентность 2?
Это объясняется строением электронной оболочки металлов. Обычно, металлы имеют неполностью заполненную внешнюю энергетическую оболочку, которая состоит из s- и p-орбиталей. Как правило, валентные электроны находятся именно на внешних s- и p-орбиталях. Если металл имеет наиболее стабильную энергетическую структуру, когда все электроны на внешних s- и p-орбиталях заполнены, то валентность такого металла будет равна 2.
Валентность элементов металлов: причины двухвалентности

Валентность элементов металлов – это их способность образовывать химические соединения с другими элементами. В случае многих металлов валентность равна двум. Почему так происходит?
Одной из причин двухвалентности элементов металлов является строение и распределение электронов в их внешней электронной оболочке. Валентная оболочка металлов содержит два электрона, которые могут быть переданы на образование химической связи с другими элементами. Это обуславливает возможность образования двухвалентных соединений.
Еще одной причиной двухвалентности элементов металлов является их электроотрицательность. Металлы обладают низкой электроотрицательностью, что обуславливает их способность отдавать электроны во время образования химических связей. Двухвалентные соединения металлов могут образовываться при передаче двух электронов.
Важно учитывать, что валентность элементов металлов может различаться в разных соединениях. Некоторые металлы могут образовывать и трехвалентные или другие типы соединений в зависимости от условий и свойств сопрягающихся элементов. Однако, в большинстве случаев валентность элементов металлов остается двумвалентной.
Что такое валентность?
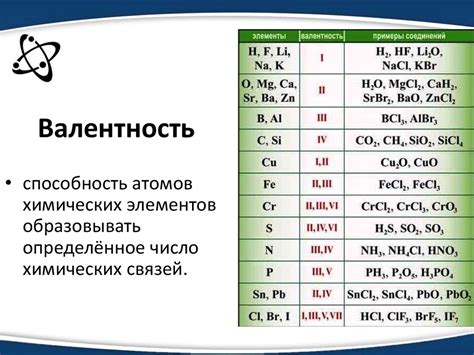
Валентность - это числовая характеристика, указывающая на количество электронов, которые может отдать или принять атом элемента при образовании химических соединений. Валентность является особенностью каждого химического элемента и определяет его способность к образованию химических связей.
Валентность элементов металлов равна двум по причине их строения атомной оболочки. Атомы металлов обычно имеют большое количество валентных электронов, расположенных во внешней энергетической оболочке. В результате этого, атомы металлов имеют тенденцию отдавать эти электроны при образовании ионов положительной валентности.
Валентность два означает, что каждый атом металла может образовывать две химические связи или отдавать два электрона. Это связано с тем, что атомы металлов имеют две энергетические подоболочки, которые могут быть заполнены валентными электронами. Заполнение этих подоболочек позволяет атому достичь более стабильного энергетического состояния, что является основой для образования химических связей.
Валентность элементов металлов играет важную роль в химии и определяет их химические свойства. Обладая высокой валентностью, металлы способны образовывать многочисленные вещества с другими элементами, что обуславливает их широкое применение в различных областях науки и техники.
Почему валентность элементов металлов равна двум?
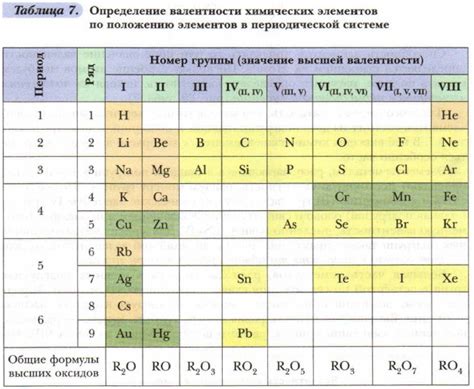
Валентность элементов металлов равна двум в связи с особенностями электронной структуры атомов. Металлы образуют катионы – положительно заряженные ионы, которые образуются путем потери электронов. Количество электронов, теряемых металлом при образовании катиона, обычно равно двум.
Электронная структура атомов металлов определяется их положением в периодической системе элементов. Металлы находятся слева от полуметаллов и неметаллов в системе. Их атомы имеют относительно большой размер и обладают низкой электроотрицательностью. Это позволяет металлам легко отдавать электроны, что приводит к образованию катионов.
При потере двух электронов многие металлы достигают электронной конфигурации следующего инертного газа в периодической системе. Например, натрий (Na) образует катион Na+, потеряв два электрона, и тем самым достигает электронной конфигурации неона (Ne). Эта стабильная конфигурация способствует стойкости катионов металлов с валентностью 2.
Из-за стойкости катионов с валентностью 2, многие металлы могут образовывать стабильные соединения с анионами, которые образуются при отрицательной зарядке неметаллов. Это позволяет металлам образовывать соли и стабильные ионные соединения. Например, цинк (Zn) имеет валентность 2 и может образовывать стабильные соединения с анионами, такими как хлор (Cl) или сульфат (SO4).
Вопрос-ответ

Для всех металлов валентность равна двум?
Нет, для всех металлов валентность не обязательно равна двум. Валентность металлов может быть разной и зависит от их электронной структуры.
Почему валентность элементов металлов равна двум?
Валентность металлов, обычно, равна двум в связи с электронной конфигурацией. В атоме металла, основным образом, заполняются энергетические уровни с 1 до 18 электронами, что обеспечивает стабильность структуры наиболее энергетически низкого состояния. При этом, оставшиеся электроны, нарушая правила заполнения энергетических уровней, могут легко участвовать в химических реакциях, образуя ионы с валентностью равной двум.
