Строение атомов элементов металла является особенным и отличается от строения атомов других химических элементов. Основными особенностями строения атомов металлов являются их электронная оболочка и число электронов в ней.
Металлические элементы имеют относительно слабую электроотрицательность и, следовательно, большой размер атома. У этих элементов электроны располагаются на внешних энергетических уровнях, образуя электронную оболочку. Внешний энергетический уровень называется валентным и определяет химическую активность металла.
Строение электронной оболочки в атомах металлов позволяет им образовывать металлическую связь. Металлы выделяются своей способностью образовывать кристаллическую решетку, в которой атомы располагаются в регулярном порядке, не имея строгой привязки к определенным координатам. Это объясняет многие физические и химические свойства металлов, такие как высокая теплопроводность и электропроводность, пластичность и деформируемость.
Структура атомов
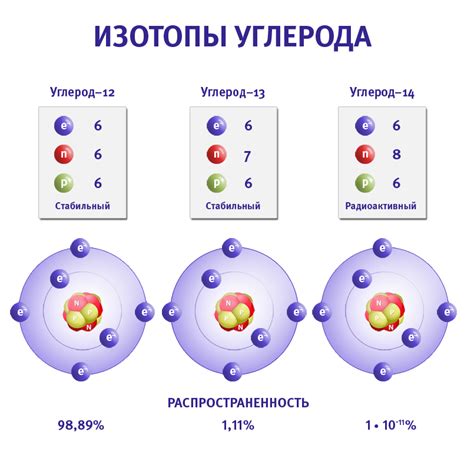
Атомы являются основными строительными блоками вещества. Они состоят из ядра, электронной оболочки и электронов.
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Протоны и нейтроны сосредоточены в центре атома, называемом ядром.
Электронная оболочка окружает ядро атома. Она состоит из электронов, которые имеют отрицательный заряд. Электроны обращаются по определенным орбитам вокруг ядра, называемым энергетическими уровнями или электронными оболочками.
Структура атома определяет его химические и физические свойства. Количеству протонов в атоме соответствует его атомный номер, который определяет его положение в периодической таблице элементов. Количество электронов в атоме равно количеству протонов, что обеспечивает электрическую нейтральность атома.
Все элементы имеют различные структуры атомов, что влияет на их свойства и способность образовывать соединения с другими элементами. Некоторые металлы, такие как железо и медь, имеют кристаллическую структуру атомов, где атомы расположены в регулярных узорах. Другие металлы, такие как алюминий и золото, имеют аморфную структуру, где атомы располагаются в беспорядке.
Определение строения

Строение атомов элементов металла обусловлено их собственными особенностями и свойствами. Атом - это наименьшая единица вещества, которая сохраняет все его химические свойства. Составляющие атомы элементов металла состоят из электронов, протонов и нейтронов. Однако, число электронов и их расположение в атоме варьируются в зависимости от элемента.
Протоны находятся в центре атома - в его ядре, которое имеет положительный заряд. Количество протонов определяет атомный номер элемента и его положение в периодической таблице. Нейтроны также находятся в ядре и не имеют заряда, их количество может варьироваться.
Электроны находятся в области вокруг ядра и имеют отрицательный заряд. Они распределены по различным энергетическим уровням - оболочкам. Как правило, ближайшая оболочка к ядру вмещает не более 2 электронов, а вторая - до 8 электронов. Количество электронов на внешней оболочке определяет химическую активность элемента. Во время химических реакций электроны переходят с одной оболочки на другую, образуя химические соединения.
Структура атомов элементов металла обуславливает их особенные свойства. Металлы обладают хорошей электропроводностью благодаря свободным электронам на внешней оболочке, которые могут перемещаться. Также, металлы обладают высокой теплопроводностью из-за свободного движения электронов и устойчивой структуры ядра. Благодаря своей специфической структуре атомов элементы металла имеют высокую пластичность и могут быть легко переработаны и использованы в различных областях промышленности.
Ядро
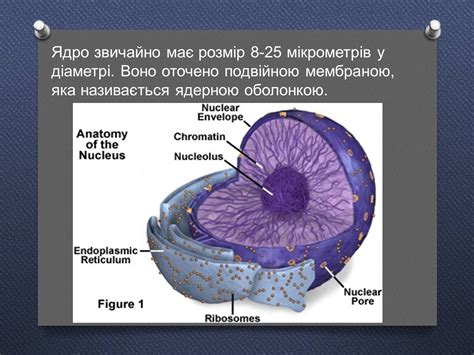
Ядро атома – это центральная часть атома, состоящая из протонов и нейтронов. Оно имеет положительный заряд, так как протоны имеют положительный заряд, а нейтроны не имеют заряда.
Протоны – это элементарные частицы с положительным электрическим зарядом. Они находятся в ядре атома и определяют его заряд. Количество протонов в ядре определяет атомный номер элемента и его положение в периодической таблице.
Нейтроны – это элементарные частицы без электрического заряда. Они также находятся в ядре атома и служат для сбалансирования зарядов протонов. Количество нейтронов в ядре может варьироваться и определяет изотоп элемента.
Ядро атома обладает высокой плотностью и сравнительно малыми размерами по сравнению с областью, где находятся электроны. Протоны и нейтроны в ядре притягиваются друг к другу с помощью сильного ядерного взаимодействия, которое преодолевает отталкивающие силы и позволяет ядру существовать в состоянии относительной стабильности.
Электроны
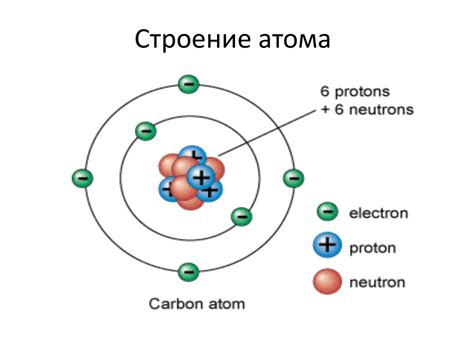
Электроны – это элементарные частицы, находящиеся вокруг ядра атома. Они обладают отрицательным электрическим зарядом и очень малой массой по сравнению с ядром атома. Электроны непрерывно двигаются по орбитальным энергетическим уровням вокруг ядра и создают электронную оболочку атома.
Количество электронов в атоме определяется атомным номером элемента. Атомы элементов с различными атомными номерами содержат разное количество электронов. Например, атом водорода содержит всего один электрон, а у атома кислорода их уже 8.
Электроны обладают спином, который может быть направлен вверх или вниз. Оба направления спина имеют одинаковую энергию. В результате этого, сколько бы электронов ни было на одной орбитальной энергетической уровне, всегда существует возможность разместить на нем еще один электрон с противоположным направлением спина. Закон запрета Паули гласит, что в одной орбитали могут находиться только два электрона с противоположным спином.
При наличии свободных электронов, элементы обладают электропроводностью. Металлы характеризуются высокой электропроводностью из-за стойкой свободной электронной конфигурации в атоме. У металлов электроны, занимающие энергетические уровни оболочек, слабо привязаны к ядру и могут свободно перемещаться в структуре металла, образуя электронное облако.
Электронные оболочки

В атоме металлического элемента электроны располагаются на электронных оболочках. Количество электронных оболочек у атома зависит от его порядкового номера в периодической системе. На первой оболочке может находиться не более 2 электронов, на второй – не более 8 электронов, на третьей – не более 18 электронов и т.д.
Каждая электронная оболочка состоит из подоболочек, которые могут содержать определенное количество электронов. Подоболочки обозначаются буквами: s, p, d, f. Электроны могут располагаться в подоболочках в определенном порядке, согласно правилам заполнения.
Наиболее близко к ядру атома располагается первая электронная оболочка, которая заполняется первыми двуми электронами. Следующие оболочки заполняются постепенно, начиная с электронов на более близких к ядру подоболочках. Правило заполнения подоболочек указывает на необходимость заполнения подоболочек в определенном порядке с учетом их энергетического уровня.
Знание о распределении электронов по электронным оболочкам позволяет понять химические свойства металлических элементов. Количество и конфигурация электронов на последней оболочке металла определяет его химическую активность и возможность вступать в химические реакции.
Валентные электроны
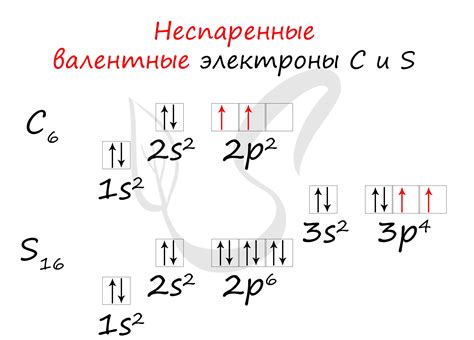
Валентные электроны - это электроны, находящиеся на самом внешнем энергетическом уровне атома. Они играют ключевую роль в химических реакциях и образовании химических связей.
Число валентных электронов определяется группой (вертикальным столбцом) в периодической системе элементов. Например, элементы из первой группы имеют одну валентную электрон, элементы из второй группы - две валентных электрона и так далее.
Валентные электроны определяют химические свойства элемента. Элементы с одинаковым числом валентных электронов обладают схожими химическими свойствами. Например, все элементы с 4 валентными электронами образуют 4-валентные соединения, такие как углерод в органических соединениях.
Валентные электроны могут образовывать химические связи с валентными электронами других атомов. Это происходит при обмене, добавлении или донорстве электронов. При образовании связей валентные электроны образуют пары или становятся непарными.
Наличие валентных электронов позволяет элементам образовывать различные химические соединения и соединяться с другими элементами для создания разнообразных структур, например, кристаллических решеток металлов.
Орбитали
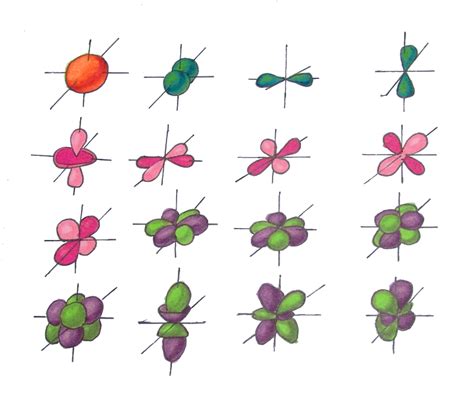
Орбитали – это области пространства вокруг атомного ядра, в которых с большей вероятностью находятся электроны. Орбитали описывают энергетические уровни электронов и их движение.
Орбитали могут быть разных форм и размеров. Существуют s-орбитали, p-орбитали, d-орбитали и f-орбитали. Они различаются по форме и ориентации в пространстве. S-орбитали имеют форму сферы и области с высокой плотностью электронов находятся ближе к ядру. P-орбитали имеют форму поперечной долины и могут быть ориентированы в трех взаимно перпендикулярных направлениях.
Каждая орбиталь может вместить определенное количество электронов. S-орбиталь может содержать максимум 2 электрона, p-орбиталь – 6 электронов, d-орбиталь – 10 электронов, а f-орбиталь – 14 электронов.
Орбитали заполняются электронами согласно принципу заполнения электронных оболочек. Сначала заполняются орбитали с более низкой энергией, а затем орбитали с более высокой энергией.
Орбитали являются основными строительными блоками атомов и определяют химические свойства элементов. Именно орбитали электронов взаимодействуют с другими атомами при возникновении химических связей и образовании соединений.
Связь между атомами
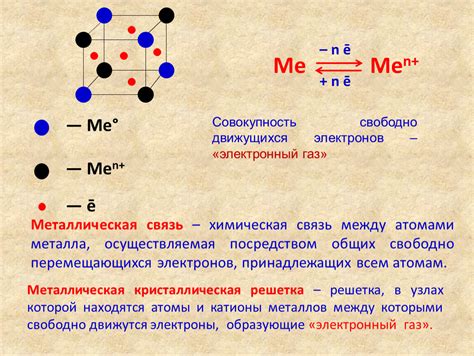
Атомы металлов обладают особыми свойствами, которые обусловлены их структурой и связью между собой. За счет особенностей строения электронной оболочки атома, металлы образуют специфическую связь, называемую металлической связью.
Металлическая связь характеризуется тем, что электроны в металлической решетке не принадлежат отдельным атомам, а движутся по всей структуре металла. Это связано с наличием свободных электронов, которые легко перемещаются между атомами. Такая связь имеет массовый характер и является одним из ключевых свойств металлов.
Металлическая связь обусловливает ряд особенностей поведения металлов. Одной из таких особенностей является электропроводность. Благодаря свободным электронам, металлы легко проводят электрический ток. Также металлы обладают высокой теплопроводностью, это связано с быстрым перемещением электронов внутри металлической решетки.
Связь между атомами в металлах также обуславливает их механические свойства. Металлы обладают высокой прочностью и упругостью. Это связано с тем, что металлическая связь позволяет электронам перемещаться и передавать напряжение между атомами, что делает материал устойчивым к деформациям.
Разновидности атомов

Атомы элементов металла могут иметь различные разновидности в зависимости от количества электронов в их оболочках. Каждый атом состоит из ядра, которое содержит протоны и нейтроны, и оболочек, на которых находятся электроны.
Существует несколько типов атомов металла. Наиболее распространенными разновидностями являются одноатомные и многоатомные атомы. Одноатомные атомы состоят только из одного ядра и нескольких оболочек с электронами. Многоатомные атомы, как следует из их названия, содержат более одного ядра и соответственно большее количество электронов.
Также атомы могут иметь разные энергетические уровни и располагаться на разных оболочках. Наиболее низкий энергетический уровень называется основным, а следующие уровни - возбужденными состояниями. Атомы металла имеют определенное количество электронов на каждом уровне и способны переходить с одного уровня на другой при взаимодействии с внешними факторами, такими как теплота или электрическое поле.
Стоит отметить, что различные атомы элементов металла имеют разную структуру и количество электронов на оболочках. Именно это делает их уникальными и определяет их химические и физические свойства, такие как проводимость, пластичность и твердость. Продолжение исследований структуры атомов металла позволяет углубить наши знания о свойствах и поведении таких материалов и использовать их в различных отраслях промышленности и науки.
Вопрос-ответ

Какова особенность строения атомов металлов?
Особенностью строения атомов металлов является наличие наружной электронной оболочки, которая не полностью заполнена электронами. Это делает атомы металлов склонными к образованию ионов положительной заряды и обеспечивает им свойства металлического проводника электричества и тепла.
Почему атомы металлов образуют ионы положительной заряды?
Атомы металлов образуют ионы положительной заряды (катионы) из-за наличия наружной электронной оболочки, которая не полностью заполнена электронами. Для достижения более стабильного состояния, атомы металла отдают электроны, чтобы заполнить оболочку до полного октаэдра или до заполнения s-подуровня. Это приводит к образованию ионов, имеющих меньшее количество электронов, чем нейтральные атомы.
Какая связь между строением атомов и свойствами металлов?
Строение атомов металлов, в частности наличие наружной электронной оболочки с неполным заполнением, обуславливает ряд свойств металлов. Наличие свободных электронов наружной оболочки позволяет атомам металла образовывать ионы положительной заряды, поэтому металлы являются хорошими проводниками электричества и тепла. Также, свободные электроны в металлах способствуют образованию металлической связи, что делает металлы пластичными и деформируемыми.
Каким образом строение атомов металлов влияет на их химические свойства?
Строение атомов металлов, особенно наличие наружной электронной оболочки с неполным заполнением, существенно влияет на химические свойства металлов. Именно наличие свободных электронов наружной оболочки позволяет металлам образовывать ионы положительной заряды и проявлять активность в химических реакциях. Кроме того, свободные электроны способствуют проведению электрического тока, теплоотдаче и обладают высокой подвижностью, что существенно влияет на химическую активность металлов.
