Группа элементов II периода периодической таблицы Менделеева включает в себя элементы от бериллия до магния. Все элементы этой группы обладают типично металлическими свойствами, которые делают их особенными среди других элементов таблицы.
Одним из ключевых свойств группы элементов II периода является их способность образовывать катионы с двойным положительным зарядом. Это связано с наличием двух внешних электронов в свободном состоянии, которые легко могут быть потеряны, образуя положительный ион. Именно из-за этой способности элементы этой группы часто используются в различных процессах электролиза и обладают высокой электропроводимостью.
Кроме того, элементы группы II периода обладают высокой термической и химической стабильностью. Это делает их применимыми в различных инженерных и технологических процессах, где требуется высокая степень надежности и устойчивости материалов.
Химические соединения элементов II периода также обладают уникальной реакционной способностью. Например, окислы этих элементов являются основными окислителями и образуют щелочные соединения, которые широко используются в различных отраслях промышленности и научных исследованиях.
Важно отметить, что элементы группы II периода находят широкое применение в различных областях науки и промышленности благодаря своим уникальным свойствам. Они также играют важную роль в биологических системах и имеют значительное воздействие на окружающую среду. Знание и понимание этих свойств позволяет разрабатывать новые материалы и технологии, обеспечивая прогресс и инновации в различных сферах человеческой деятельности.
Атомы и их строение

Атом - это наименьшая частица вещества, сохраняющая его химические свойства. Он состоит из атомного ядра и электронной оболочки.
Атомное ядро, содержащее протоны и нейтроны, находится в центре атома. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Электроны, обладающие отрицательным зарядом, находятся вокруг ядра на электронных оболочках.
Количество протонов в ядре определяет атомный номер элемента. Также атомный номер указывает на количество электронов в атоме. Нейтронов в ядре может быть разное количество, что приводит к образованию изотопов.
Электронные оболочки атома представляют собой энергетические уровни. На каждом уровне может находиться определенное количество электронов. Первая оболочка может содержать максимум 2 электрона, вторая - до 8, третья - до 18 и так далее. Из-за стремления атома достичь более стабильного состояния, электроны заполняют оболочки последовательно.
Электроны на наружной оболочке называют валентными. Именно их взаимодействие с другими атомами определяет химические свойства вещества. Если валентная оболочка не заполнена полностью, атом может образовывать химические связи с другими атомами для достижения стабильности.
Физические свойства

Группа элементов II периода включает химические элементы литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F) и неон (Ne). У этих элементов есть общие физические свойства, характерные для металлов.
Первое из этих свойств - металлический блеск, обусловленный отражением света от поверхности металлов. Он вызван наличием свободных электронов в проводимости, которые создают металлическую свободную электронную оболочку.
Второе свойство - теплопроводность. Металлы хорошо проводят тепло благодаря быстрому передвижению свободных электронов, которые могут принимать и передавать тепловую энергию.
Третье свойство - электропроводность. Металлы обладают способностью проводить электрический ток, так как свободные электроны могут передвигаться под действием электрического поля.
Четвертое свойство - пластичность и формоизменяемость. Металлы легко поддаются обработке и могут быть вытянуты в проволоку или спрессованы в листы, что делает их очень гибкими в использовании.
Пятая особенность - высокая плотность. Металлы обладают большей плотностью по сравнению с другими веществами из-за плотной структуры и слабого межмолекулярного пространства.
Химические свойства

Элементы II периода таблицы Менделеева обладают химическими свойствами, типичными для металлов. Они активно вступают в реакции с другими элементами, образуя химические соединения.
Одной из характерных химических свойств группы II периода является способность образовывать соединения с кислородом. Эти элементы легко окисляются, образуя соединения с положительным зарядом, известные как оксиды.
Еще одним важным химическим свойством элементов II периода является способность образовывать соли. Взаимодействуя с кислотами, они образуют соли, которые, в свою очередь, являются основанием многих промышленных процессов.
Элементы II периода также проявляют способность образовывать стабильные гидриды. Гидриды этой группы имеют металлическую структуру и обладают высокой электропроводностью.
Также стоит отметить особую реакционную способность элементов II периода с некоторыми неметаллами, такими как сера и галиды. В результате этих взаимодействий образуются соединения, которые часто используются в различных отраслях промышленности.
Реакции с кислотами
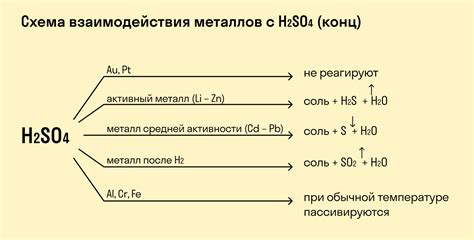
Группа элементов II периода таблицы Менделеева обладает типично металлическими свойствами. Однако, эти элементы могут реагировать с кислотами и образовывать соли.
Реакция металлов II периода с кислотами протекает с образованием водорода. Металлы обладают высокой реакционной способностью и быстро растворяются в кислотах, активно вступая во взаимодействие.
Содержание концентрации и характер кислоты могут влиять на скорость и интенсивность реакции. Реактивность элементов II периода возрастает от магния к цинку. Магний реагирует с минеральными кислотами, например, с серной кислотой, образуя соли и выделяя водород. Цинк может реагировать и с серной кислотой, и с солями, образуя соответствующие соли.
Реакции металлов II периода с кислотами применяются в химическом производстве и лабораторной практике. Взаимодействие металлов с кислотами может быть использовано для получения нужных солей или для осаждения чистого металла из его раствора.
Влияние на окружающую среду

Группа элементов II периода, включающая бериллий, магний, кальций, стронций, барий и радий, имеет типично металлические свойства. Взаимодействие данных элементов с окружающей средой может привести к определенным последствиям для экосистемы.
Один из ключевых факторов влияния данных элементов на окружающую среду - их различная степень токсичности. Некоторые элементы, такие как бериллий, известны своей высокой токсичностью и способностью накапливаться в организмах живых существ. Их попадание в окружающую среду может вызывать вредные последствия для здоровья людей и животных.
Кроме того, промышленное производство и использование данных элементов может сопровождаться выбросами вредных веществ в атмосферу, воду и почву. Это может приводить к загрязнению окружающей среды и нарушению ее экологического равновесия.
Некоторые элементы группы II периода, такие как магний, кальций и стронций, также могут взаимодействовать с веществами в окружающей среде и оказывать влияние на ее химические и биологические процессы. Например, кальций принимает участие в формировании карбонатных отложений и может влиять на качество воды.
Таким образом, элементы группы II периода могут оказывать как положительное, так и отрицательное влияние на окружающую среду. Важно проводить контроль и мониторинг выбросов данных элементов в окружающую среду, а также исследовать их влияние на экосистему для обеспечения устойчивого развития и сохранения природных ресурсов.
Вопрос-ответ

Какие свойства характерны для группы элементов II периода?
Группа элементов II периода включает в себя металлы, такие как бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом типично металлических свойств. Они хорошо проводят электричество и тепло, обладают металлическим блеском, обычно имеют высокую плотность и тугоплавкие. Кроме того, они образуют положительные ионы (катионы) в реакциях с другими элементами.
Какие металлы входят в группу элементов II периода?
Группа элементов II периода включает в себя металлы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы характеризуются высокой плотностью, тугоплавкостью, хорошей проводимостью электричества и тепла. Они также имеют металлический блеск и способны образовывать положительные ионы в реакциях.
