Ряд напряжения металлов в электрохимии - это упорядоченная по возрастанию таблица, которая отражает относительную способность металлов выступать в качестве окислителей или восстановителей при электрохимических реакциях. Она является важным инструментом для понимания и прогнозирования реакций, происходящих в электрохимических системах.
Ряд напряжения металлов основан на наблюдении, что некоторые металлы обладают более высокой электрохимической активностью, чем другие. Такие металлы легче отдают свои электроны и выступают в качестве окислителей, в то время как более пассивные металлы служат восстановителями, принимая электроны.
Ряд напряжения металлов широко используется в электрохимических исследованиях и синтезе веществ. Он позволяет определить, какие металлы могут быть использованы в качестве анодов и катодов в электролизе, а также прогнозировать потенциалы электродных реакций при различных условиях. Кроме того, ряд напряжения металлов можно использовать для определения относительных степеней окисления металлов и расчета электродных потенциалов.
Сущность ряда напряжения металлов

Ряд напряжения металлов - это упорядоченный список, в котором металлы расположены в порядке возрастания их окислительно-восстановительного потенциала. Он позволяет определить относительную активность металлов в электрохимических процессах.
Сущность ряда напряжения металлов заключается в следующем: металлы, занимающие более высокое положение в ряду, имеют больший окислительный потенциал и могут окислять металлы, находящиеся ниже их в ряду. Таким образом, при контактировании двух различных металлов происходит электронный перенос, и металл с более высоким окислительным потенциалом превращается в катод, а металл с более низким потенциалом - в анод.
Ряд напряжения металлов является одним из основных инструментов в электрохимии. Он помогает прогнозировать направление электрохимических реакций, определять степень oкисления и восстановления металлов, а также может быть использован для составления электрохимических цепей и разработки электрохимических источников энергии.
Применение ряда напряжения металлов в практике

Ряд напряжения металлов широко применяется в различных областях практики, особенно в электрохимии. Он позволяет определить относительную активность металлов и их способность выступать в реакциях окисления и восстановления.
Применение ряда напряжения металлов в практике позволяет производить гальваническое покрытие, которое активно используется в металлургической и машиностроительной промышленности. Такое покрытие позволяет защитить поверхность металла от коррозии, а также придать ей дополнительные свойства, такие как повышенная твёрдость или электропроводность.
Ряд напряжения металлов также применяется при подборе материалов для создания гальванических элементов и элементов электротехники. Он позволяет определить, какой металл является лучшим анодом или катодом в конкретной реакции, и выбрать оптимальные материалы для создания электрических цепей.
Кроме того, ряд напряжения металлов используется при проведении электрохимических исследований и определении электродных потенциалов. Он позволяет определить порядок происходящих в реакции окисления и восстановления и выявить возможность возникновения электрохимических процессов.
Таким образом, ряд напряжения металлов имеет широкое применение в различных областях практики, обеспечивая эффективное использование металлов в электрохимических процессах, выбор оптимальных материалов и проведение исследований в области электрохимии.
Определение напряжения металлов в ряду
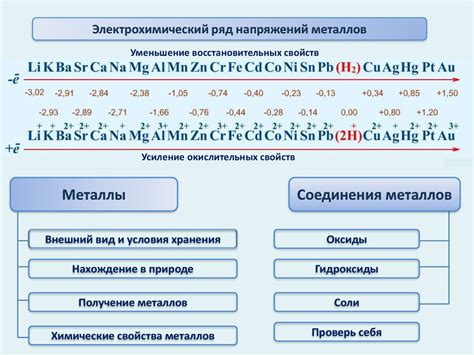
Напряжение металлов в ряду – это физическая величина, которая определяет способность металла вступать в реакции окисления и восстановления. Это параметр, который позволяет оценить, насколько металл стабилен в окружающей среде и может служить анодом или катодом в электрохимических процессах.
Для определения напряжения металлов в ряду необходимо провести электрохимические исследования, в том числе измерения потенциалов электродов. Важно отметить, что напряжение металлов можно измерять как в относительных значениях (по отношению к стандартным электродам), так и в абсолютных значениях (вольтах).
В результате исследований был составлен ряд напряжения металлов, из которого видно, каким образом основные металлы располагаются относительно друг друга по степени их окисляемости. Например, в ряду напряжения металлов наиболее активным металлом является литий, а наименее активным – золото.
Знание ряда напряжения металлов позволяет не только понять и объяснить многие электрохимические процессы, но и использовать это знание на практике. Например, зная напряжение металлов в ряду, можно подобрать соответствующие материалы для создания анодов и катодов в электролизерах, батареях и других устройствах, а также определить, какой металл может выступать в качестве антикоррозионного покрытия для других металлов.
Влияние концентрации на напряжение металлов
В электрохимии важную роль играет концентрация раствора, в котором находится металл. Значение данного параметра может оказывать существенное влияние на напряжение металла, которое является ключевым показателем его активности в электрохимических процессах.
Концентрация влияет на напряжение металла потенциально, то есть на его способность отдавать или принимать электроны. При изменении концентрации раствора, меняется количество ионов, взаимодействующих с поверхностью металла, что приводит к изменению потенциала.
Повышение концентрации раствора может приводить к увеличению или уменьшению напряжения металла в зависимости от его свойств и условий проведения эксперимента. Например, для некоторых металлов повышение концентрации может приводить к увеличению их активности, а для других – к уменьшению или даже полному прекращению реакций на электроде.
Определение зависимости напряжения металла от концентрации является важным этапом в исследовании его электрохимического поведения. Для этого проводятся эксперименты, в ходе которых фиксируется напряжение металла при различных значениях концентрации раствора. Полученные результаты могут быть представлены в виде графика или таблицы, что позволяет более наглядно оценить влияние концентрации на электрохимические свойства металла.
В заключении, концентрация раствора является важным фактором, который определяет напряжение металла в электрохимических процессах. Изменение концентрации может приводить к значительным изменениям активности металла, что необходимо учитывать при проведении исследований и расчетах в электрохимии.
Изменение состава ряда напряжения металлов с температурой

Ряд напряжения металлов представляет собой упорядоченную по величине последовательность металлов, расположенных в порядке убывания их электрохимической активности. Напряжение метала является мерой его способности восстанавливать положительно заряженные ионы или окислять отрицательно заряженные ионы в растворе.
Изменение состава ряда напряжения металлов с температурой является одной из основных характеристик этого ряда. По мере повышения температуры, электрохимическая активность металлов может изменяться. Некоторые металлы могут стать более активными, а другие – менее активными.
Например, при повышении температуры ряд напряжения металлов может измениться таким образом, что металл, ранее находившийся выше по ряду, становится активнее, чем металл, находившийся ниже по ряду. Это связано с изменением энергетических свойств металлов при изменении их температуры.
- Одним из примеров изменения состава ряда напряжения металлов с температурой является изменение напряжения для железа и цинка. При комнатной температуре цинк обладает большей электрохимической активностью и у большинства электрохимических пар восстанавливает соединения железа. Однако, при повышении температуры, ряд напряжения меняется - активность цинка снижается и превалирующим становится восстановление соединений железа металлом.
- Другим примером изменения состава ряда напряжения металлов с температурой является изменение активности алюминия и железа при повышении температуры. При комнатной температуре, железо обладает большей активностью и может восстановить соединения алюминия. Однако, при повышении температуры, активность железа снижается, и алюминий становится активнее.
Таким образом, изменение состава ряда напряжения металлов с температурой является важным фактором, который необходимо учитывать при проведении электрохимических реакций. Эти изменения могут быть объяснены изменением энергетических свойств металлов при изменении их температуры и могут оказать существенное влияние на электрохимические процессы, такие как анодная и катодная реакции.
Вопрос-ответ

Как формируется ряд напряжения металлов в электрохимии?
Ряд напряжения металлов в электрохимии формируется на основе их способности к окислению и восстановлению. Он представляет собой упорядоченный список металлов, которые реагируют с водными ионами в растворах, образуя ионы металла и свободные электроны. Металлы, имеющие большую способность отдавать электроны, располагаются вверху ряда, а металлы с меньшей способностью - внизу. Этот ряд используется для предсказания направления и возможности реакций в электрохимии.
Для чего используется ряд напряжения металлов в электрохимии?
Ряд напряжения металлов в электрохимии используется для предсказания направления и возможности реакций, происходящих в электрохимических системах. Он позволяет определить, какой металл будет окисляться, а какой восстанавливаться, при электролизе или во время реакции окисления-восстановления. Кроме того, ряд напряжения металлов позволяет сравнить электродный потенциал различных металлов и выбрать материалы для электродов и гальванических элементов.
