Химические источники тока играют важную роль в нашей жизни, обеспечивая работу множества устройств, которыми мы пользуемся ежедневно. Одним из основных принципов работы таких источников является электрохимический ряд напряжений металлов. Этот ряд позволяет определить, какая пара металлов может служить электродами в элементах электрических цепей, а также установить порядок их возникновения электродных потенциалов.
Каждый металл имеет свой характерный электродный потенциал, который связан с его способностью участвовать в электрохимических реакциях. Чем выше потенциал металла, тем больше его способность отдавать электроны и тем более активный он является. На основе электрохимического ряда можно сделать вывод, что активная металлическая пара будет получать электроны от менее активной металлической пары в электрохимическом процессе.
Основной пример применения электрохимического ряда – это гальванические элементы, такие как батарейки. В них используются два различных по активности металла, например, цинк и медь. Цинк является более активным, поэтому он отдаст электроны меди, тем самым создавая разность потенциалов между двумя электродами. Эта разность потенциалов и является источником тока.
Интересный факт! Электрохимический ряд был открыт в 1801 году английским химиком и физиком Вильгельмом Югенсом.
Химические источники тока:

Химические источники тока являются одним из способов преобразования химической энергии в электрическую. Они состоят из двух электродов, погруженных в электролит, и способны создавать постоянный ток.
В электрохимическом ряду напряжений металлов представлены элементы, упорядоченные по их способности окисляться или восстанавливаться. Металлы, расположенные выше в ряду, способны легко окисляться и служат анодами, а металлы, расположенные ниже, восстанавливаются и служат катодами.
Электрохимический ряд позволяет предсказывать направление течения электродных реакций в химических источниках тока. При подключении внешней нагрузки электроны начинают двигаться от анода к катоду, создавая электрическую силу тока.
Примером химических источников тока являются аккумуляторы. Они состоят из двух половинок - положительной и отрицательной. На положительной половинке находится анод, на котором происходит окисление, а на отрицательной половинке - катод, на котором происходит восстановление. При зарядке аккумулятора электролит переносит ионы между половинками, а при разрядке - обратный процесс.
Электрохимический ряд напряжений металлов

Электрохимический ряд напряжений металлов - это таблица, в которой отражены значения стандартных окислительно-восстановительных потенциалов различных металлов. Она позволяет сравнить активности металлов и зафиксировать их способность к окислению и восстановлению.
В таблице электрохимического ряда напряжений металлы располагаются в порядке убывания их стандартных потенциалов. Более активные металлы находятся в верхней части таблицы, а менее активные - в нижней. Образование потенциала основывается на разности величин энергии взаимодействия окислителя с атомом металла и величиной энергии, выделяемой при его окислении.
Из таблицы напряжений металлов следует, что более активные металлы имеют большую тенденцию переходить в ионы и восстанавливаться, а менее активные металлы имеют меньшую тенденцию к окислению и более легко восстанавливаются. Одинаковые элементы различных состояний окисления приведены в таблице отдельно. В таблице также указано, что мыло взаимодействует с атомами металлов.
Зная значения стандартных потенциалов, можно предсказать, как будут протекать электрохимические реакции в электролизере или при работе гальванической ячейки. Также электрохимический ряд может быть использован для определения активности металлов в реакциях с растворами солей или для выбора электрода в гальванической ячейке.
Определение и принцип работы
Химический источник тока - это устройство, которое преобразует химическую энергию в электрическую энергию. Он состоит из двух электродов - анода и катода, между которыми находится электролит.
Принцип работы химического источника тока основан на электрохимических реакциях, происходящих на электродах. Когда электроды погружены в электролит, происходит окислительно-восстановительная реакция: на аноде происходит окисление, а на катоде - восстановление. Эти реакции сопровождаются переносом электронов через внешнюю цепь, вследствие чего образуется электрический ток.
Для работы химического источника тока на аноде должно происходить окисление катиона, а на катоде - восстановление аниона. При этом энергия, выделяющаяся в результате электрохимической реакции, используется для создания разности потенциалов, которая приводит к движению электронов по внешней цепи. Подключение электрической нагрузки к источнику тока приводит к появлению электрического тока в цепи.
Реакции окисления и восстановления
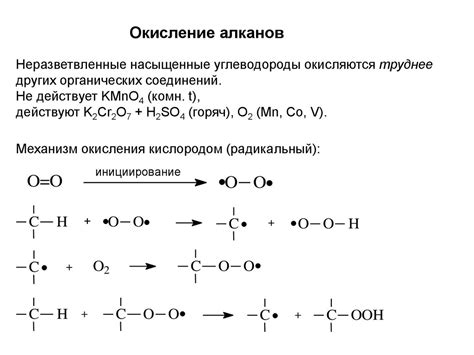
Реакции окисления и восстановления – это важный процесс, происходящий в химических реакциях. Окисление представляет собой процесс потери электронов, а восстановление – процесс получения электронов.
Окисление и восстановление являются взаимосвязанными процессами и происходят одновременно. В окислительно-восстановительных реакциях количество окисляемых частиц и количество восстанавливаемых частиц всегда одинаково.
Окислитель – вещество, принимающее электроны и при этом само восстанавливающееся. Восстановитель – вещество, отдавающее электроны и при этом само окисляющееся.
Окисление и восстановление играют важную роль в электрохимических реакциях, таких как реакции в химических источниках тока. Например, в гальванических элементах происходит окисление одного металла и восстановление другого металла через электрический ток.
Реакции окисления и восстановления также широко применяются в других сферах, например, в химической промышленности и аналитической химии.
Видеоурок для 9 класса
На видеоуроке для 9 класса мы рассмотрим тему "Химические источники тока: электрохимический ряд напряжений металлов". Эта тема является частью курса химии и позволяет учащимся познакомиться с основными понятиями электрохимии и понять принцип работы химических источников тока.
На уроке мы изучим электрохимический ряд напряжений металлов, который отображает их способность к окислению и восстановлению в электрохимических реакциях. Будет рассмотрено, какие металлы являются сильными окислителями, а какие - сильными восстановителями.
Ученики узнают, как по электрохимическому ряду можно определить направление тока и куда перемещаются электроны в противоположных полюсах элементов. Также будет объяснено, что такое стандартный электродный потенциал и как его использовать для определения силы окислителя и восстановителя в электрохимических реакциях.
В процессе видеоурока будут приведены примеры реакций, которые происходят при соединении различных металлов. Ученики узнают, почему при использовании определенных металлов в химических источниках тока происходит более эффективная конверсия химической энергии в электрическую.
Видеоурок по электрохимическому ряду напряжений

В данном видеоуроке мы рассмотрим одно из ключевых понятий в химии - электрохимический ряд напряжений металлов. Этот ряд позволяет определить, какой металл является сильным окислителем, а какой - сильным восстановителем.
Введение в тему начинается с объяснения основных понятий: окислитель, восстановитель и электрохимический потенциал. Затем переходим непосредственно к электрохимическому ряду напряжений, который является упорядоченным списком металлов по их способности отдавать или принимать электроны.
Выделяют два типа реакций: реакции окисления и реакции восстановления. Реакции окисления проходят с участием сильного окислителя, а реакции восстановления - с участием сильного восстановителя. Электрохимический ряд позволяет определить, какая реакция будет протекать, и какие вещества будут участвовать в данной реакции.
Для лучшего запоминания электрохимического ряда можно использовать следующую аббревиатуру:
- Казахстанский - Ка
- Адам - Ад
- Конунгович - Ко
- Магнит - Ма
- Никимазар - Ни
- Вильгельму - Ви
- Царю - Ца
- Латынину - Ла
- Иван - Ив
- Анатольевич - Ан
Данный видеоурок позволит учащимся лучше понять электрохимический ряд напряжений металлов и его применение в химических реакциях. Изучив эту тему, ученик сможет легче справиться с решением задач и пониманием химических процессов, происходящих в их повседневной жизни.
Задачи и упражнения по теме

1. Расположите следующие металлы в порядке убывания их окислительной активности: цинк (Zn), медь (Cu), железо (Fe), алюминий (Al), серебро (Ag).
Ответ: серебро (Ag), алюминий (Al), цинк (Zn), железо (Fe), медь (Cu).
2. Какие из перечисленных металлов будет реагировать с кислотами: свинец (Pb), магний (Mg), никель (Ni), аргон (Ar)?
Ответ: магний (Mg) и никель (Ni) реагируют с кислотами.
3. При помощи электрохимического ряда напряжений металлов определите, какой металл будет выделяться из раствора своей соли при замене металла под действием электрического тока: цинк (Zn) или медь (Cu)?
Ответ: медь (Cu).
4. В раствор цинкового купороса (ZnSO4) было погружено свинцовое покрытие. Что произойдет с покрытием под действием электрического тока, если его пропустить через раствор?
Ответ: покрытие будет растворяться, а на месте погруженного свинца будут выделяться ионы цинка.
5. Разделите следующие металлы на группы по их способности выделяться из растворов своих солей под действием электрического тока: медь (Cu), никель (Ni), аргон (Ar), алюминий (Al).
Ответ: группа 1: медь (Cu), никель (Ni); группа 2: аргон (Ar), алюминий (Al).
Вопрос-ответ

Каково определение электрохимического ряда напряжений металлов?
Электрохимический ряд напряжений металлов - это упорядоченный по возрастанию список металлов, в котором каждый металл расположен в зависимости от его способности отдавать или принимать электроны в химических реакциях.
Для чего нужен электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов позволяет определить, какие металлы могут служить анодами, а какие катодами в гальваническом элементе или в электролизере.
Как правильно использовать электрохимический ряд напряжений металлов?
Для использования электрохимического ряда напряжений металлов, нужно сперва найти в ряду два металла, между которыми будет большая разность между их напряжениями (чем больше разность, тем больше потенциал разности двух металлов). Потом можно использовать эти металлы для создания гальванического элемента или электролизера.
Какие металлы находятся в верхней части электрохимического ряда напряжений?
В верхней части электрохимического ряда напряжений находятся металлы с высокими потенциалами - например, литий, калий, натрий и алюминий.
