Электрохимический ряд напряжений металлов – это таблица, которая отображает электрохимическую активность различных металлов. Она широко используется при изучении электрохимических процессов и реакций, а также в химии и электрохимии в целом. Важным аспектом использования таблицы является определение способности металла к окислению или восстановлению, а также возможность предсказания направления электрохимической реакции.
Таблица электрохимического ряда напряжений металлов отображает упорядоченный список металлов в порядке их активности. В основе данного ряда лежит потенциал окисления – потенциал реакции, при которой происходит окисление одного вещества и восстановление другого. Металлы с большими значениями потенциала окисления считаются активными, тогда как металлы с меньшими значениями – менее активными.
Таблица электрохимического ряда напряжений металлов используется для предсказания результатов электрохимических процессов. Например, зная расположение металла в таблице, можно сказать, будет ли он окисляться или восстанавливаться при взаимодействии с другими металлами или электролитами. Также таблица может быть использована для определения напряжения элементов электрохимического элемента и для выбора электродных пар для различных химических процессов.
Электрохимический ряд напряжений металлов:

Электрохимический ряд напряжений металлов - это таблица, которая располагает металлы в порядке убывания их способности вступать в реакцию с кислородом по отношению к стандартному водородному электроду. Уравновешенная реакция в ряду имеет положительное значение электрического потенциала.
Электрохимический ряд напряжений металлов является важной информацией для определения спонтанности и направления электрохимических реакций. Чем выше металл расположен в ряду, тем больше его способность быть окисленным и, следовательно, тем более активным он является.
В таблице электрохимического ряда напряжений металлов самым активным является литий (Li) с самым отрицательным потенциалом. Затем идут другие щелочные металлы, такие как натрий (Na) и калий (K). Затем следуют металлы алкалиноземельных металлов, землеалклиний, платина, медь, серебро и другие металлы.
Электрохимический ряд напряжений металлов используется для определения того, какие металлы реагируют с кислородом в атмосфере или в растворе. Таблица также может быть использована для определения наиболее эффективных материалов для использования в электрохимических батареях и гальванических элементах.
Металлы, расположенные в верхней части электрохимического ряда напряжений, могут быть окислены более активными металлами, находящимися ниже по ряду. Это явление известно как гальваническая коррозия и может быть существенной проблемой для многих материалов, особенно при соприкосновении с влажными средами.
Таблица электрохимического ряда напряжений металлов имеет большое значение в химической и электротехнической промышленности, а также в научных исследованиях. Понимание электрохимического ряда можно использовать для предсказания химических реакций и выбора оптимальных материалов для различных технологических процессов и устройств.
Таблица для печати ЕГЭ
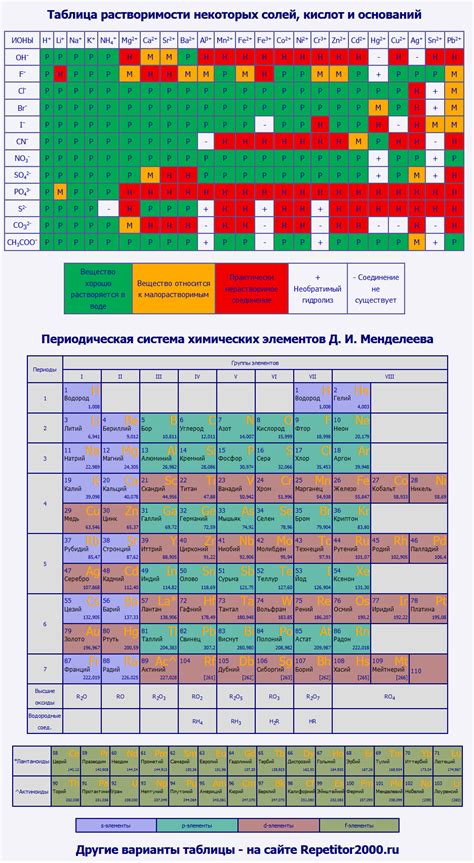
Во время подготовки к ЕГЭ по химии одной из полезных информационных таблиц является электрохимический ряд напряжений металлов. Эта таблица помогает ученикам лучше понять взаимодействие различных металлов в реакциях окисления и восстановления.
В электрохимическом ряду напряжений металлы располагаются в порядке убывания их активности, то есть их склонности быть окисленными или восстановленными. В самом верху ряда находятся наиболее активные металлы, такие как литий и калий, а в самом низу – менее активные металлы, такие как медь и серебро.
В таблице указываются значения стандартного окислительно-восстановительного потенциала (электродного потенциала) для различных металлов. Отрицательное значение означает, что металл будет восстанавливаться, а положительное значение – окисляться. Чем больше разница в потенциалах двух металлов, тем сильнее протекает реакция восстановления или окисления.
Используя электрохимический ряд напряжений металлов, ученики могут определить, какие металлы способны замещать другие металлы в реакциях. Также они могут понять, в какой последовательности осаждается металл на электрод (положительных и отрицательных), в том числе и при проведении электролиза.
Важность знания ряда напряжений металлов для подготовки к ЕГЭ

Ряд напряжений металлов - это таблица, отражающая относительную активность металлов в реакциях окисления и восстановления. Понимание этого ряда является важным аспектом подготовки к экзамену ЕГЭ по химии.
Знание ряда напряжений металлов позволяет определить возможность прохождения электрохимических реакций. По таблице можно узнать, какое вещество будет окисляться, а какое восстанавливаться в реакции.
На экзамене ЕГЭ по химии встречаются задачи, связанные с анализом электрохимических реакций. Знание ряда напряжений металлов позволит без труда определить, какой металл будет окисляться и какой будет восстанавливаться. Это поможет правильно записать полуреакции и собрать уравнение реакции.
Помимо решения задач, знание ряда напряжений металлов поможет лучше понять и запомнить основные принципы электрохимии. Благодаря таблице можно выявить связь между активностью металлов и их положением в ряду напряжений. Это знание поможет студентам лучше разобраться в причинах протекания электрохимических процессов.
Как используется электрохимический ряд напряжений металлов на ЕГЭ

Электрохимический ряд напряжений металлов – это таблица, которая показывает упорядоченный список металлов по их электрохимической активности. Такая таблица широко используется на ЕГЭ при решении задач, связанных с электрохимией.
Электрохимический ряд позволяет определить направление протекания реакции окисления и восстановления при взаимодействии металлов с ионами других металлов. Это основополагающий принцип в процессе разделения металлов и определения их активности.
На ЕГЭ часто предлагаются задачи, в которых нужно определить, высвободится ли металл из раствора, сравнивая его активность с активностью металла, находящегося в растворе. Для этого необходимо сравнить их положение в электрохимическом ряду. Металл, стоящий выше в ряду, является более активным и может вытеснить металл, стоящий ниже.
Также, электрохимический ряд часто используется для определения напряжения элементарной ячейки в гальванических элементах и определения теоретической ЭДС при работе этих элементов. По таблице легко определить потенциал восстановления и окисления металлов и построить цепь переноса электронов в гальванической ячейке.
Примеры задач по электрохимическому ряду напряжений металлов на ЕГЭ
Пример 1:
Дана таблица с электрохимическим рядом напряжений металлов. Необходимо определить, какой металл будет реагировать с раствором серной кислоты (H2SO4) с выделением водорода.
| Металл | Напряжение, В |
|---|---|
| Магний (Mg) | -2.37 |
| Цинк (Zn) | -0.76 |
| Серебро (Ag) | +0.80 |
| Медь (Cu) | +0.34 |
Решение: Металлы с большими значениями напряжений (более положительными) имеют более высокую активность и запаздывают в ряду. Металлы с отрицательными значениями напряжений обладают большей склонностью к окислению и обычно реагируют с кислотами. Таким образом, металл, который будет реагировать с раствором серной кислоты и выделять водород, - это магний (Mg).
Пример 2:
Известно, что цинк (Zn) вступает в реакцию с раствором серной кислоты (H2SO4), образуя соли и выделяя водород. Необходимо определить, какой из следующих металлов будет реагировать с этим раствором с выделением водорода: серебро (Ag), медь (Cu) или железо (Fe).
- Медь (Cu) - напряжение +0.34 В
- Железо (Fe) - напряжение -0.44 В
- Серебро (Ag) - напряжение +0.80 В
Решение: Чтобы определить, какой металл будет реагировать с раствором серной кислоты, нужно найти металл с наименьшим (более отрицательным) значением напряжения. Из представленных металлов это железо (Fe) с напряжением -0.44 В. Таким образом, железо будет реагировать с раствором серной кислоты и выделять водород.
Пример 3:
Раствор медного(II) сульфата (CuSO4) взаимодействует с цинком (Zn), при этом на цинке образуется слой меди. Необходимо определить, какой металл активнее: цинк или медь.
- Цинк (Zn) - напряжение -0.76 В
- Медь (Cu) - напряжение +0.34 В
Решение: Металл с более положительным значением напряжения является более активным. Исходя из данных таблицы, медь (Cu) является более активным металлом. Таким образом, медь будет вытеснять цинк из его соединений, и на поверхности цинка образуется слой меди.
Подготовка к ЕГЭ по электрохимическому ряду напряжений металлов

ЕГЭ по электрохимическому ряду напряжений металлов – это одно из самых сложных испытаний для школьников. Для успешной подготовки необходимо освоить все основные понятия и принципы этого раздела химии. В электрохимическом ряду напряжений металлов отображены электродные потенциалы различных металлов относительно стандартного водородного электрода.
Основная задача ЕГЭ – определить направление процессов окисления и восстановления, связанных с электрохимическими реакциями металлов. При этом необходимо уметь рассчитывать электродные потенциалы относительно стандартного водородного электрода и определять потенциал рядоместообразования для пары веществ.
Для облегчения подготовки к ЕГЭ по электрохимическому ряду напряжений металлов рекомендуется изучить таблицу с электродными потенциалами металлов и их оксидов. Эта таблица позволит вам легко определить, какие металлы легче окислять, а какие – восстанавливать. Также полезно изучить основные правила построения электрохимического ряда и преобразования таблицы стандартных потенциалов в направление реакции.
С освоением электрохимического ряда напряжений металлов помогут также различные учебники и пособия по химии. Важно не только учить теоретический материал, но и решать практические задачи, чтобы научиться применять полученные знания на практике. Регулярная тренировка поможет закрепить основные принципы и уверенно сдать ЕГЭ по электрохимическому ряду напряжений металлов.
Вопрос-ответ

Зачем нужен электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов нужен для определения относительной активности металлов в химических реакциях. Он позволяет предсказать, будет ли металл растворяться в растворе другого вещества или же выпадет в осадок.
Что такое электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов - это таблица, в которой металлы расположены по убыванию их электрохимической активности. На основании этого ряда можно определить, какой металл будет действовать как анод, а какой как катод в электрохимической реакции.
