Электрохимический ряд напряжений металлов - это систематическое упорядочивание различных металлов по их способности вступать в электрохимические реакции. В основе этого ряда лежит ряд напряжений, которые отражают возможную силу электрического тока, генерируемого металлом при взаимодействии с раствором электролита.
Определение электрохимического ряда напряжений металлов позволяет установить их потенциалы окисления или восстановления. В этом ряду металлы, обладающие более высокими значениями напряжений, имеют большую способность к окислительным реакциям, а металлы с более низкими значениями напряжений представляют больший интерес для восстановительных реакций. Таким образом, электрохимический ряд напряжений металлов является индикатором их активности в электрохимических процессах.
Применение электрохимического ряда напряжений металлов широко распространено в различных областях науки и техники. Он используется в электрохимии для определения потенциалов электродов, рассчета электродного потенциала системы и предсказания возможных электрохимических реакций. В химическом анализе электрохимический ряд служит для определения доли компонентов в составе сплавов и соединений, а также для разделения и концентрирования различных металлов. Также этот ряд находит применение в процессах гальванизации, анодирования, коррозии и других электрохимических методах, используемых в металлургии и материаловедении. В целом, электрохимический ряд напряжений металлов придает большую значимость изучению и практическому использованию электрохимических процессов в различных отраслях науки и производства.
Что такое электрохимический ряд напряжений металлов?

Электрохимический ряд напряжений металлов – это таблица, отражающая их способность вступать в реакцию окисления или восстановления. Металлы в этом ряду располагаются в порядке убывания их стандартного потенциала – величины, характеризующей их активность в электрохимических процессах.
Стандартный потенциал измеряется в вольтах и показывает разницу потенциалов двух половинок элементарной электрохимической ячейки, в которых находятся исследуемый металл и стандартный редуктор – водород. Металлы с положительным стандартным потенциалом являются более активными и способны вступать в реакцию окисления. Металлы с отрицательным стандартным потенциалом находятся в менее активной форме.
Электрохимический ряд используется для определения технологических возможностей использования металлов в различных процессах. Например, он позволяет определить, какой металл будет растворяться при взаимодействии с раствором или какие реакции окисления и восстановления будут проходить в данной системе. Электрохимический ряд также находит свое применение в гальванических элементах, аккумуляторах и других электрохимических устройствах.
Принцип работы электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов представляет собой упорядоченный список металлов по их способности окисляться или восстанавливаться в электрохимических реакциях. На верхушке ряда находятся самые активные металлы, способные образовывать положительные ионы при контакте с растворами ионных соединений. На нижнем конце ряда расположены менее активные металлы, которые труднее отдавать электроны и образовывать отрицательные ионы.
Принцип работы электрохимического ряда основан на разности потенциалов между различными металлами. Активность металла определяется его потенциалом окисления, который можно измерить величиной электродного потенциала. Металл с более высоким электродным потенциалом считается активным, а металл с более низким потенциалом – менее активным.
При контакте двух металлов с различным электродным потенциалом возникает электрический ток, так как происходит перераспределение электронов. Металл с более высоким электродным потенциалом (более активный) становится анодом и отдаёт электроны, а металл с более низким потенциалом (менее активный) становится катодом и принимает электроны.
Использование электрохимического ряда напряжений металлов имеет широкое применение в различных областях, таких как производство электрохимических элементов, гальваническое покрытие, коррозионная защита металлов и т.д. Зная электрохимические свойства металлов и их потенциалы окисления, можно выбрать оптимальные пары металлов для создания электрохимических систем с нужными характеристиками и возможностью передачи электрической энергии.
Применение электрохимического ряда напряжений металлов в химических процессах

Электрохимический ряд напряжений металлов является важным инструментом в химических процессах. Он определяет способность металла к окислительно-восстановительным реакциям и позволяет предсказывать направление потока электронов во время реакции.
Одним из основных применений электрохимического ряда напряжений металлов является определение предпочтительного окислителя или восстановителя в химической реакции. Металлы, расположенные выше в ряду, имеют большую способность к окислению и являются хорошими окислителями, тогда как металлы, расположенные ниже, имеют большую способность к восстановлению и являются хорошими восстановителями.
Также электрохимический ряд напряжений металлов используется в определении металлической активности и стабильности материалов. Более активные металлы могут быть склонны к коррозии или анодному растворению, поэтому знание их положения в ряду помогает в выборе материалов для конструкций или оборудования, чтобы избежать нежелательных процессов разрушения.
Электрохимический ряд напряжений металлов также находит применение в процессах гальванического покрытия и электролиза. В гальваническом покрытии металлы с более низким потенциалом окисления используются как аноды, а металлы с более высоким потенциалом окисления используются как катоды. Таким образом, происходит осаждение металлического покрытия на поверхности анода.
Также, электрохимический ряд напряжений металлов могут быть использован для предсказания электродных потенциалов и этапов реакции в электролизных процессах. Этот метод может быть использован для определения электродного потенциала и эффективности электролитических процессов, что является важным для разработки и улучшения электрохимических устройств и технологий.
Определение позиции металла в электрохимическом ряду напряжений

Электрохимический ряд напряжений металлов — это список металлов, упорядоченных по их способности вступать в реакции окисления и восстановления. Позиция металла в этом ряду позволяет определить его химическую активность и его способность к электрохимическим реакциям.
Определить позицию металла в электрохимическом ряду напряжений можно с помощью опытного метода, называемого "методом сравнения напряжений". Устанавливаются две полуячейки с растворами солей двух металлов, и между ними помещается пробник, состоящий из проводящего материала, обычно платины. Затем измеряется напряжение на зажимах пробника.
Положительное напряжение на зажимах пробника свидетельствует о том, что раствор соли первого металла имеет большую способность окислять пробник, чем раствор соли второго металла. Следовательно, первый металл будет находиться выше в электрохимическом ряду напряжений.
Чем больше напряжение, тем выше металл в ряду. В некоторых источниках электрохимический ряд напряжений металлов представлен в виде таблицы, в которой позиция металла указывается по его электродному потенциалу.
Знание позиции металла в электрохимическом ряду напряжений играет важную роль в различных областях, таких как электрохимическое осаждение металлов, электролиз, гальваническая коррозия и другие процессы, связанные с взаимодействием металлов с растворами электролитов.
Влияние электрохимического ряда напряжений на реакции окисления и восстановления
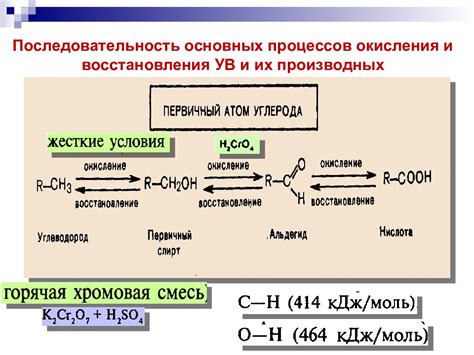
Электрохимический ряд напряжений металлов является важным инструментом для предсказания химических реакций окисления и восстановления. В данной таблице металлы располагаются по возрастанию их окислительной активности, от наиболее активного до наименее активного. Отношение различных металлов в этом ряду позволяет определить, будет ли происходить реакция окисления или восстановления при контакте с другими веществами.
Если более активный металл находится в контакте с менее активным металлом или соединением, то он обладает достаточной силой, чтобы окислить менее активный металл или соединение. В этом случае реакция окисления происходит, а более активный металл выступает в роли окислителя. Например, цинк (Zn) может окислить медь (Cu), если они находятся в контакте, и в результате образуется ион цинка и ион меди.
С другой стороны, если менее активный металл находится в контакте с более активным металлом или соединением, то менее активный металл подвергается реакции восстановления. В этом случае более активный металл является восстановителем и принимает на себя электроны от менее активного металла или соединения. Например, медь (Cu) может восстановить ион цинка (Zn), если они находятся в контакте, и в результате образуется цинк и медные ионы.
Таким образом, электрохимический ряд напряжений металлов позволяет предсказать, какие металлы и соединения могут взаимодействовать друг с другом в химических реакциях окисления и восстановления. Эта информация имеет важное практическое применение в различных областях, включая электрохимию, гальванические элементы, коррозию и многие другие.
Электрохимический ряд напряжений металлов и коррозия

Электрохимический ряд напряжений металлов представляет собой систематическую таблицу, в которой металлы располагаются в порядке убывания их потенциала окисления. В соответствии с этим порядком металлы классифицируют на активные (более электроотрицательные) и пассивные (менее электроотрицательные).
Когда два различных металла находятся в контакте с электролитом, электрохимическая активность каждого металла приводит к возникновению разности потенциалов между ними. В результате этого процесса один из металлов может участвовать в электрохимической реакции коррозии. В этом случае активный металл будет подвергаться коррозии, а пассивный металл будет служить токопроводящей средой для этой реакции.
Например, в контакте с раствором солей, большинство металлов может подвергаться коррозии. Однако, благодаря электрохимическому ряду напряжений металлов, можно определить, к какому из металлов процесс коррозии будет протекать. Металлы, находящиеся в табличном списке ниже по активности, будут подвергаться коррозии, в то время как металлы, находящиеся выше, будут защищать их. Эта информация является основой для выбора защитных покрытий и использования катодной защиты для предотвращения коррозии.
| Металлы | Потенциал окисления (В) |
|---|---|
| Литий | -3,04 |
| Калий | -2,93 |
| Магний | -2,37 |
| Алюминий | -1,66 |
| Цинк | -0,76 |
| Железо | -0,44 |
| Медь | +0,34 |
| Серебро | +0,80 |
| Золото | +1,50 |
Использование электрохимического ряда напряжений металлов позволяет определить вероятные реакции коррозии в различных условиях и выбрать методы защиты и предотвращения коррозии. Для этого необходимо учитывать активность металла, окружающую среду и наличие других факторов, которые могут влиять на процессы коррозии.
Электрохимический ряд напряжений металлов в биологических системах

Электрохимический ряд напряжений металлов – это упорядоченный список металлов по их электрохимической активности. В биологических системах этот ряд играет важную роль, так как определяет потенциал окислительно-восстановительного взаимодействия различных металлов.
В биологии электрохимический ряд металлов используется для объяснения ряда биохимических процессов. Например, он помогает понять, почему некоторые металлы, такие как железо и цинк, являются необходимыми для нормального функционирования организма, в то время как другие металлы, такие как свинец и медь, могут быть токсичными.
Электрохимический ряд позволяет определить, какие металлы обладают большей активностью и способны вытеснять металлы с меньшей активностью из их соединений. Например, цинк может вытеснить медь из ее соединений, так как он находится выше меди в электрохимическом ряду.
На основе электрохимического ряда металлов могут быть разработаны биологические и медицинские методы, связанные с использованием металлов. Например, электрохимическая коррозия металлов может быть применена для уничтожения определенных видов микроорганизмов. Также, электрохимический ряд металлов используется в медицине при разработке имплантатов и протезов.
Преимущества и ограничения использования электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов – это удобный инструмент, который позволяет оценить относительную активность металлов в реакциях окисления и восстановления. Преимущества его использования включают:
- Определение потенциала электрода: Электрохимический ряд позволяет оценить потенциал металлического электрода относительно стандартного водородного электрода. Это позволяет понять, как металл будет реагировать в окружающей среде.
- Определение возможности реакций: Зная положение металла в электрохимическом ряду, можно предсказать, будет ли реакция между ним и другими веществами происходить самопроизвольно или требовать внешнего воздействия.
- Сравнение активности металлов: Электрохимический ряд позволяет установить, какой металл будет самым активным и какой - наименее активным, благодаря чему можно прогнозировать и контролировать реакции между различными металлами.
- Определение направления электродных процессов: Электрохимический ряд позволяет определить направление потока электронов в электродных процессах и прогнозировать химическую реакцию, происходящую на электроде.
Однако, использование электрохимического ряда также имеет некоторые ограничения. Например:
- Игнорирование кинетических факторов: Ряд игнорирует скорость химической реакции, а фактор кинетики может существенно влиять на возможность прохождения электрохимической реакции.
- Влияние концентрации: Ряд предполагает, что реагенты находятся в стандартных условиях, однако изменение концентрации веществ может влиять на положение металла в ряду.
- Отсутствие учета окружающей среды: Ряд не учитывает влияние физической и химической среды на характер реакции и изменение положения металлов в ряду.
Несмотря на данные ограничения, электрохимический ряд напряжений металлов остается полезным инструментом для предварительной оценки реакционной способности металлов и предсказания возможных химических реакций.
Вопрос-ответ

Как определить положение металла в электрохимическом ряду напряжений?
Положение металла в электрохимическом ряду напряжений можно определить по его потенциалу окисления или восстановления. Чем выше потенциал, тем больше возможность вступления в окислительно-восстановительные реакции и, следовательно, тем выше металл в ряду. Например, кальций имеет самый низкий потенциал окисления, поэтому он находится внизу ряда, а литий имеет самый высокий потенциал окисления, так что он находится вверху ряда.
Какое практическое применение имеет электрохимический ряд напряжений металлов?
Электрохимическим рядом напряжений металлов можно пользоваться для определения возможности и направления электрохимических реакций. Он используется в различных областях, таких как электрохимия, гальваника, а также в процессе выбора материалов для создания гальванических элементов и коррозионной защиты. Например, зная положение металла в ряду, можно предсказать, будет ли он растворяться в растворе или нет, и использовать эту информацию для защиты металлических конструкций от коррозии.
