Электрохимический ряд напряжений металлов – это таблица, отражающая относительную активность различных металлов в химических реакциях. Он позволяет определить, какой металл будет действовать как анод, а какой как катод при электролизе или при реакции окисления и восстановления. Электрохимический ряд имеет широкое применение в различных областях, таких как электрохимия, гальванические элементы, электрокатализ, а также в промышленных процессах и электрохимической защите металлов.
В основе электрохимического ряда лежит принцип сравнения потенциалов окислительно-восстановительных пар в реакциях, в которых участвуют металлы. Он формируется путем упорядочивания металлов по их потенциалам окисления или восстановления. Металлы, расположенные выше в ряду, являются сильными окислителями и имеют больший потенциал окисления, чем металлы, расположенные ниже. Таким образом, в реакции окисления и восстановления между металлами первый является окислителем, а второй – восстановителем.
Например, по электрохимическому ряду, металл цинк, расположенный выше металла меди, может отдавать электроны меди, и при этом происходит окисление цинка и восстановление меди.
Электрохимический ряд имеет большое практическое значение. С его помощью можно предсказать направление потока электронов в электрохимической ячейке, где происходит гальваническая реакция. Кроме того, электрохимический ряд используется для определения стандартного потенциала окисления или восстановления металла, что позволяет оценивать его активность в химических реакциях. Этот ряд также помогает в выборе материалов при создании гальванических элементов и определении электрохимической стабильности материалов в различных условиях.
Электрохимический ряд напряжений металлов

Электрохимический ряд напряжений металлов представляет собой перечень металлов, упорядоченных по возрастанию или убыванию их степени активности в реакциях окисления и восстановления. Этот ряд позволяет определить направление потока электронов в электрохимической реакции и предсказать возможность и скорость процесса.
В электрохимическом ряду напряжений металлы расположены таким образом, что металлы, находящиеся выше в ряду, имеют большую способность к восстановлению (более активные), а металлы, находящиеся ниже, имеют большую способность к окислению (менее активные). Например, литий, калий и натрий, которые расположены выше в ряду, имеют большую активность и быстро окисляются в воде или кислотах, тогда как металлы, находящиеся ниже, такие как медь или серебро, имеют меньшую активность и могут быть восстановлены только сильными окислителями.
Основная причина различия в активности металлов заключается в их электрохимическом потенциале, который определяется способностью металла отдавать или принимать электроны. Металлы, имеющие более низкий электрохимический потенциал, с большей вероятностью будут восстановлены, в то время как металлы с более высоким потенциалом будут окислены.
Электрохимический ряд напряжений металлов находит широкое применение в различных областях, включая электрохимическую коррозию, гальванические элементы и электролиз. Он позволяет предсказывать, какие металлы будут корродировать в различных средах, а также определять напряжение и энергию, выделяемые в электрической цепи при взаимодействии различных металлов.
Основные понятия электрохимического ряда
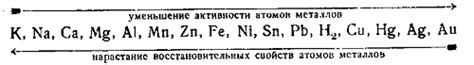
Электрохимический ряд напряжений металлов — это упорядоченный список металлов по их способности отдавать или принимать электроны в химических реакциях. При составлении этого ряда металлы располагаются в порядке убывания их потенциалов окисления (или восстановления). Верхнее место ряда занимает металл с наибольшим потенциалом окисления.
Каждому металлу в электрохимическом ряду соответствует свой потенциал окисления (ПО), который можно измерить вольтметром. Потенциал окисления показывает, сколько электродов данного металла будет выделяться или поглощаться при окислительно-восстановительных реакциях. Металлы с более высокими значениями потенциала окисления считаются более активными, тогда как те, у которых потенциал окисления ближе к нулю, считаются менее активными.
Электрохимический ряд металлов необходим для рассмотрения и определения возможности проведения электрохимических реакций и реакций замещения. По этому ряду можно определить, возможно ли окисление данного металла в растворах его солей и реакции замещения металла в химических соединениях.
Принципы электрохимического ряда
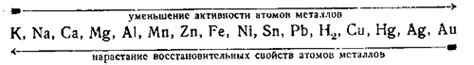
Электрохимический ряд напряжений металлов — это упорядоченный по величине список металлов и полуметаллов, расположенных в порядке убывания их стандартного электродного потенциала. Принципы, лежащие в основе этого ряда, определяют возможность электрохимических реакций и направление течения электрического тока.
Первый принцип — принцип соприкосновения — гласит, что металлы в контакте с электролитами могут реагировать, образуя растворимые или нерастворимые соединения. При этом электрический ток проходит от металла с более низким потенциалом к металлу с более высоким потенциалом.
Второй принцип — принцип концентраций ионов — заключается в том, что направление и скорость электрохимической реакции определяются концентрациями ионов в растворе электролита. Если концентрация ионов металла в растворе выше, чем стандартные значения их потенциалов, то происходит окисление металла и выделение ионов в растворе. В противоположном случае проявляется противоположный эффект.
Третий принцип — принцип комплексных соединений — указывает на то, что электродный потенциал металла может зависеть от его соединения в растворе электролита. Например, через образование комплексных соединений электродные потенциалы некоторых металлов могут быть изменены в сторону повышения или понижения.
Таким образом, принципы электрохимического ряда являются основой для понимания электрохимических процессов и позволяют прогнозировать направление и интенсивность электрохимических реакций.
Влияние электрохимического ряда на свойства металлов

Электрохимический ряд напряжений металлов определяет их способность протекать электрохимические реакции и влияет на их свойства. В зависимости от положения металла в ряду, его реакционная активность может быть различной.
Металлы, расположенные выше в электрохимическом ряду, называются активными. Они обладают большей реакционной активностью и склонностью к окислительным реакциям. Такие металлы часто обладают способностью растворяться в кислотах или образовывать ионы в растворе.
Металлы, расположенные ниже в ряду, называются пассивными. Они менее активны и обладают меньшей склонностью к окислительным реакциям. Такие металлы не растворяются в кислотах и сохраняют свою структуру и свойства в средах с низким окислительно-восстановительным потенциалом.
Электрохимический ряд также определяет возможность возникновения гальванической коррозии при контакте двух различных металлов. Если два металла в контакте находятся на разных концах ряда, то более активный металл будет действовать как анод и будет подвергаться коррозии, а более пассивный металл будет действовать как катод и будет защищать себя.
Исходя из этих свойств, электрохимический ряд находит применение во многих областях, включая электрохимию, гальваническое покрытие, производство электрической энергии и другие технические процессы, связанные с взаимодействием металлов.
Применение электрохимического ряда в практике

Электрохимический ряд является важным инструментом для решения различных задач и применяется в различных областях практики. Одним из основных применений электрохимического ряда является определение относительной степени активности металлов. По значению электродного потенциала каждого металла можно определить, какой из них будет окисляться, а какой будет восстанавливаться.
Кроме определения активности металлов, электрохимический ряд находит применение в гальванических элементах и аккумуляторах. Гальванический элемент производит электрический ток за счет осаждения и растворения металлов на электродах, а аккумулятор накапливает электрическую энергию в химической форме и может использоваться для питания различных устройств.
Электрохимический ряд также используется для определения направления химических реакций. Если металл, имеющий более высокий потенциал, находится в контакте с металлом, имеющим более низкий потенциал, то произойдет окислительно-восстановительная реакция, при которой более активный метал будет окисляться, а менее активный будет восстанавливаться.
Кроме того, электрохимический ряд применяется в коррозионных процессах и методах защиты металлов от коррозии. Зная потенциал металла и его положение в электрохимическом ряду, можно предсказать, какой из металлов будет подвержен коррозии при контакте с другими материалами и какие методы защиты можно применить для предотвращения коррозии.
В целом, электрохимический ряд является важным инструментом для понимания и управления химическими реакциями, а его применение в различных областях практики позволяет разрабатывать новые технологии и методы, основанные на электрохимии.
Экспериментальное определение напряжения металлов
Определение напряжения металлов в электрохимическом ряду может быть проведено с помощью экспериментов. Для этого необходимо соединить исследуемый металл с металлом, который является эталоном и имеет известное напряжение. Обычно в качестве эталонного металла используется стандартный водородный электрод.
Экспериментальное определение напряжения металлов может производиться путем измерения электродного потенциала металлов при их взаимодействии с эталонным металлом. Для этого используется специальное устройство - вольтметр, который позволяет измерять разность потенциалов между металлами.
Для проведения эксперимента необходимо установить проводник, образующий электрическую цепь между металлами, а также электролит, который будет служить средой для передачи электрического заряда. При этом важно, чтобы электролит был не реактивным по отношению к металлам и не влиял на их потенциалы.
С помощью эксперимента можно установить, какой металл имеет более высокий потенциал, а какой - более низкий. Металл с более высоким потенциалом считается анодом, а с более низким - катодом. Таким образом, экспериментальное определение напряжения металлов позволяет установить их положение в электрохимическом ряду и предсказывать их способность к различным электрохимическим реакциям.
Роль электрохимического ряда в реакциях окисления-восстановления
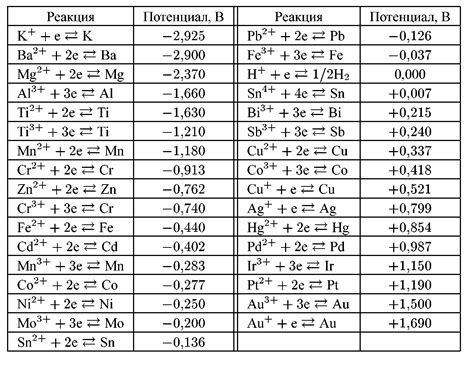
Электрохимический ряд напряжений металлов играет ключевую роль в реакциях окисления-восстановления, так как позволяет определить направление потока электронов при прохождении электрического тока через электролитическую ячейку.
Каждый металл в ряду имеет определенное окислительное или восстановительное свойство, которое определяется его способностью отдавать или принимать электроны. Металлы расположены в ряду таким образом, что металлы, расположенные ближе к верхней части ряда, имеют более высокое окислительное свойство, а металлы, расположенные ближе к нижней части ряда, имеют более высокое восстановительное свойство.
При проведении реакций окисления-восстановления в электролитической ячейке электроны перемещаются от металла с более низким окислительным свойством к металлу с более высоким окислительным свойством. Таким образом, металлы, расположенные ближе к верхней части ряда, служат в качестве окислителя, а металлы, расположенные ближе к нижней части ряда, служат в качестве восстановителя.
Электрохимический ряд позволяет определить стандартный электродный потенциал реакции окисления-восстановления для каждой пары металлов. Стандартный электродный потенциал показывает, насколько легко металл восстанавливается или окисляется при контакте с другим металлом. Поэтому электрохимический ряд является важным инструментом для предсказания возможности протекания реакции окисления-восстановления и выбора электродов для электролиза или гальванических элементов.
Изменение положения металлов в электрохимическом ряду под влиянием условий

Положение металлов в электрохимическом ряду напряжений зависит от их способности отдавать или принимать электроны при окислительно-восстановительных реакциях. Однако это положение может изменяться в зависимости от различных условий.
Влияние концентрации ионов металла в растворе также может привести к изменению его положения в ряду. Например, увеличение концентрации ионов металла может способствовать усилению его окислительных свойств, что приведет к смещению его положения в ряду в сторону более высоких потенциалов. Наоборот, уменьшение концентрации ионов металла может уменьшить его активность и сместить его положение в ряду в сторону более низких потенциалов.
Повышение температуры также может оказывать влияние на положение металлов в электрохимическом ряду. Обычно повышение температуры способствует увеличению скорости окислительно-восстановительных реакций, что может приводить к изменению потенциала металла и смещению его положения в ряду.
Кроме того, на положение металлов в электрохимическом ряду может влиять pH раствора. Изменение pH может изменять концентрацию ионов в растворе и степень гидратации металла, что в свою очередь может изменить его активность и потенциал.
Таким образом, положение металлов в электрохимическом ряду не является постоянным и может изменяться под влиянием различных условий, таких как концентрация ионов, температура и pH раствора.
Вопрос-ответ

Что такое электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов - это таблица, в которой металлы располагаются в порядке возрастания их потенциала окисления или восстановления. Этот ряд показывает, какие металлы являются более активными, а какие - менее активными в отношении электрохимических реакций.
Как строится электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов строится по принципу вытеснения металлов из растворов ионами других металлов. Для этого проводятся специальные эксперименты, в которых сравниваются способности разных металлов образовывать ионы. В результате этих экспериментов составляется таблица, в которой металлы упорядочиваются в порядке их активности.
Зачем нужен электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов является важным инструментом для определения возможности и направления химических реакций. Он позволяет предсказывать, какие металлы будут взаимодействовать друг с другом, а также какие металлы будут окисляться или восстанавливаться в электрохимических реакциях.
Какие металлы считаются активными, а какие - менее активными в электрохимическом ряду напряжений?
В электрохимическом ряду напряжений металлы, расположенные выше по списку, считаются более активными, т.е. они имеют большую способность окисляться и отдавать электроны. Например, литий, натрий и калий считаются очень активными металлами. Металлы, расположенные ниже по ряду, считаются менее активными, т.е. они имеют меньшую способность окисляться и больше предпочитают принимать электроны.
