Электрохимический ряд активности металлов является одной из важных тем в химии. Он представляет собой упорядоченный список металлов, расположенных по их активности в реакциях окисления и восстановления. Этот ряд позволяет определить, какие металлы обладают большей способностью отдавать электроны, а какие — принимать.
Изучение электрохимического ряда активности металлов позволяет понять множество важных процессов, таких как коррозия металлов, процессы электролиза и батареев. Он также является основой для построения электрохимических элементов и устройств.
В электрохимическом ряде активности металлы расположены по возрастанию их стандартных электродных потенциалов. Наиболее активные металлы находятся вверху ряда, а наименее активные — внизу. Взаимодействие металлов и их соединений с веществами определяется их положением в этом ряде.
Электрохимический ряд активности металлов

Электрохимический ряд активности металлов представляет собой упорядоченный список металлов в порядке убывания их активности в реакциях окисления и восстановления.
Вначале ряда находятся самые активные металлы, такие как литий, калий и натрий, которые легко окисляются, отдавая электроны. В конце ряда располагаются наименее активные металлы, например, серебро и золото, которые практически не взаимодействуют с растворами кислот.
Когда два металла находятся в контакте друг с другом в растворе и существует разность их активности, происходит электролитическая реакция. Более активный металл будет окисляться, отдавая электроны, а менее активный металл будет восстанавливаться, принимая электроны. Это обусловлено тем, что металл с более высокими свойствами активности будет иметь большую способность отдавать электроны, тогда как металл с более низкими свойствами активности будет иметь меньшую способность поддерживать поток электронов.
Электрохимический ряд активности металлов имеет практическое значение в различных областях, включая промышленность, электролиз и гальванические элементы. Он также позволяет предсказать, как будет происходить перенос электронов в реакции, и определить, какой металл будет становиться анодом (отдающим электроны) и какой металл будет становиться катодом (принимающим электроны) при использовании электролитических систем.
Понятие активности металлов

Активность металлов – это способность металлов вступать в химические реакции с другими веществами. Активность металлов определяется их электрохимической активностью и позицией в электрохимическом ряду.
Электрохимический ряд активности металлов представляет собой таблицу, в которой металлы упорядочены в порядке возрастания реакционной способности. На верхней части ряда находятся самые активные металлы, которые реагируют с водой и кислородом из воздуха. На нижней части ряда находятся металлы, которые реагируют только с кислотами и не реагируют с водой и кислородом.
Чем выше металл расположен в электрохимическом ряду, тем большее вещество он может вытеснить из соединений. Таким образом, металлы, находящиеся выше в таблице, обладают большей активностью и могут вытеснить металлы, находящиеся ниже.
Активность металлов имеет важное практическое значение. Она определяет их способность к коррозии, использованию в различных процессах, а также возможностью использования в анодных материалах электрохимических элементов.
Применение электрохимического ряда активности металлов

Электрохимический ряд активности металлов является важным инструментом в химии, который позволяет определить относительную активность различных металлов. На основе этого ряда можно предсказать, как будут протекать реакции окисления и восстановления металлов.
Применение электрохимического ряда активности металлов имеет широкий спектр. Одним из его важных применений является предсказание возможности реакций растворения металлов. Металлы выше в ряду активности будут растворяться в растворах ионов металлов, которые находятся ниже их позиции в ряду. Например, металлы такие как цинк или железо растворяются в растворах меди или серебра.
Вторым важным применением электрохимического ряда является определение относительной силы окислителей и восстановителей. В реакциях оксидации-восстановления металлы выше в ряду активности окисляются, а металлы ниже восстанавливаются. Благодаря этому ряду можно определить, какой металл будет действовать как окислитель или восстановитель в данной реакции.
Также электрохимический ряд активности металлов применяется в гальванических элементах и аккумуляторах, где металлы используются для генерации электродной разности потенциалов. Металлы с высокими значениями потенциала будут служить как аноды, а металлы с низкими значениями - как катоды.
Археологическое значение электрохимического ряда активности
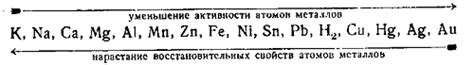
Археологическое значение электрохимического ряда активности заключается в его применении для определения старины и происхождения артефактов, найденных в археологических раскопках. Этот ряд позволяет определить реакционную активность металлов и их способность к окислению или восстановлению в контакте с окружающей средой.
Используя электрохимический ряд активности, археологи могут установить, какие металлы использовались для создания конкретных предметов, таких как оружие, украшения или бытовые предметы. Например, если был найден предмет, сделанный из металла, который находится выше железа в ряду активности, то это означает, что предмет создан из более активного металла, чем железо.
Электрохимический ряд активности также помогает археологам определить возраст и происхождение артефактов. Если металл, используемый для создания предмета, был добыван только в определенных регионах, то нахождение этого металла в определенном артефакте может указывать на его происхождение из этого региона. Более высокая или более низкая активность металла в ряду активности также может указывать на возраст предмета, учитывая, что активность металла может изменяться с течением времени из-за окисления или коррозии.
Получение электрохимического ряда активности металлов

Электрохимический ряд активности металлов - это таблица, которая позволяет сравнить металлы по их способности к окислению и восстановлению в реакциях.
Для получения электрохимического ряда активности металлов можно использовать метод сравнительного измерения электродного потенциала. Это основано на том, что металлы образуют электроды, на которых происходят окислительно-восстановительные реакции. Путем сравнения электродных потенциалов металлов можно определить их положение в ряду активности.
Основным способом получения электрохимического ряда активности металлов является проведение гальванических элементов на основе пары "металл-раствор его соли". Для этого необходимо приготовить электроды из исследуемых металлов и погрузить их в растворы солей. Затем подключить электроды к вольтметру и измерить разность потенциалов между ними. Результаты измерений позволяют составить электрохимический ряд активности металлов.
При составлении электрохимического ряда активности металлов металлы располагаются в порядке убывания их электродного потенциала. Таким образом, самым активным металлом будет тот, у которого наибольший электродный потенциал, а наименее активным - тот, у которого наименьший электродный потенциал. В ряду активности обычно присутствуют различные металлы, включая щелочные и щелочноземельные металлы, а также переходные и драгоценные металлы.
Сравнение активности металлов в электрохимическом ряду

Электрохимический ряд активности металлов — это упорядоченный список металлов по их способности вступать в электрохимические реакции. В этом ряду металлы располагаются в порядке возрастания активности. Активность металла определяется его способностью переходить от нейтрального состояния к положительному иону.
Чем выше металл на электрохимическом ряду, тем больше его активность. Наиболее активные металлы, такие как литий, натрий и калий, обладают способностью реагировать с водой и выделять гидроген. В то же время, наименее активные металлы, такие как медь и серебро, могут с некоторыми трудностями вступать в электрохимические реакции.
Электрохимический ряд активности металлов является основой для понимания и предсказания результатов электрохимических реакций. Он указывает на направление движения электронов при реакции окисления и восстановления. Металлы выше в ряду смогут окислять металлы ниже и отдавать электроны, тем самым осуществляя окислительные реакции. Металлы ниже в ряду будут восстанавливаться и принимать электроны, выполняя функцию восстановителя.
С помощью электрохимического ряда активности металлов можно предсказать, какие металлы будут реагировать с кислотами, оксидами и другими веществами, образуя новые соединения и выделяя газы. Также этот ряд позволяет определить возможность проведения электролиза различных электролитов. Изучение электрохимического ряда активности металлов является важным шагом в изучении основных принципов химии и позволяет лучше понять, как происходят электрохимические процессы.
Исследование реакций металлов в электрохимическом ряду

Электрохимический ряд активности металлов представляет собой систематический список металлов, упорядоченных по их способности вступать в реакции окисления или восстановления. Изучение электрохимического ряда активности металлов играет важную роль в химии и научном исследовании, так как позволяет предсказать, будет ли происходить реакция обмена электронами между двумя металлами или металлом и раствором соли.
Исследование реакций металлов в электрохимическом ряду позволяет определить их относительное положение в ряду активности и предсказать, какой металл будет восстановителем, а какой окислителем в химической реакции. Металлы, находящиеся выше в ряду активности, обладают большей способностью отдавать электроны и вступать в окислительные реакции, в то время как металлы, находящиеся ниже, имеют большую способность принимать электроны и вступать в восстановительные реакции.
Одним из основных методов исследования реакций металлов в электрохимическом ряду является проведение экспериментов с использованием гальванических элементов. Гальванический элемент представляет собой систему, в которой происходят окислительно-восстановительные реакции между двумя полуячейками, разделенными электролитом. При этом один металл выступает в качестве анода, а другой – в качестве катода. Результаты экспериментов позволяют определить направление течения электронов и вывести металлы в порядке их активности.
Также для исследования реакций металлов в электрохимическом ряду можно использовать методы плотимостного лигирования металлов или измерения электродного потенциала. Плотимостное лигирование позволяет получить покрытие металлом другого металла, что также применяется для определения его реактивности. Измерение электродного потенциала позволяет сравнить электрохимическую активность различных металлов и составить электрохимический ряд активности.
Вопрос-ответ

Какой смысл в изучении электрохимического ряда активности металлов?
Изучение электрохимического ряда активности металлов позволяет определить их способность к электрохимическим реакциям. Это важно для понимания многих процессов, связанных с применением металлов в различных областях, таких как промышленность, электроника и энергетика.
Какие металлы находятся в верхней части электрохимического ряда активности?
В верхней части электрохимического ряда активности находятся металлы, которые обладают большей способностью отдавать электроны и тем самым окисляться. Например, литий, калий, натрий, магний и алюминий являются такими металлами.
Какие металлы находятся в нижней части электрохимического ряда активности?
В нижней части электрохимического ряда активности находятся металлы, которые имеют меньшую способность отдавать электроны и, наоборот, имеют большую способность принимать электроны и окислять другие вещества. Например, медь, серебро, золото и платина являются такими металлами.
